题目内容
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol?L-1.用N2表示其反应速率为0.15mol?L-1?s-1,则所经过的时间为______;
A.2sB.3sC.4sD.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是______;
A.v(H2)=0.1mol?L-1?min-1B.v(N2)=0.1mol?L-1?min-1
C.v(NH3)=0.15mol?L-1?min-1D.v(N2)=0.002mol?L-1?min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0.下列各项能说明该反应已经达到平衡状态的是______.
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1molN≡N键的同时,断裂6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2.
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol?L-1.用N2表示其反应速率为0.15mol?L-1?s-1,则所经过的时间为______;
A.2sB.3sC.4sD.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是______;
A.v(H2)=0.1mol?L-1?min-1B.v(N2)=0.1mol?L-1?min-1
C.v(NH3)=0.15mol?L-1?min-1D.v(N2)=0.002mol?L-1?min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0.下列各项能说明该反应已经达到平衡状态的是______.
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1molN≡N键的同时,断裂6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2.
(1)由于v(N2)=0.15mol/(L?s),速率之比等于化学计量数之比,所以v(NH3)=2v(N2)=2×0.15mol/(L?s)=0.3mol/(L?s),
所以反应所经历的时间为
=3s.故选:B;
(2)反应为N2(g)+3H2(g) 2NH3(g),以氢气的反应速率为标准进行判断.
2NH3(g),以氢气的反应速率为标准进行判断.
A、ν(H2)=0.1mol/(L?min);
B、ν(N2)=0.1mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.3mol/(L?min);
C、V(NH3)=0.15mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.225mol/(L?min);
D、ν(N2)=0.002mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.003mol/(L?min);
所以反应速率最快的是B
故选:B;
(3)A.根据质量守恒,反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,不能证明该反应是否达到平衡状态,故A错误;
B.该反应放热,容器内温度不再变化,能证明该反应是达到平衡状态,故B正确;
C.断裂1molN≡N键的同时,断裂6molN-H键,正逆反应速率相等,能证明该反应达到平衡状态,故C正确;
D.无论反应是否平衡,反应消耗N2、H2与产生NH3的速率之比1:3:2,不能证明该反应达到平衡状态,故D错误;
故选:BC;
所以反应所经历的时间为
| 0.9mol?L-1 |
| 0.3mol/(L?s) |
(2)反应为N2(g)+3H2(g)
 2NH3(g),以氢气的反应速率为标准进行判断.
2NH3(g),以氢气的反应速率为标准进行判断.A、ν(H2)=0.1mol/(L?min);
B、ν(N2)=0.1mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.3mol/(L?min);
C、V(NH3)=0.15mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.225mol/(L?min);
D、ν(N2)=0.002mol/(L?min),反应速率之比等于其计量数之比,所以ν(H2)=0.003mol/(L?min);
所以反应速率最快的是B
故选:B;
(3)A.根据质量守恒,反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,不能证明该反应是否达到平衡状态,故A错误;
B.该反应放热,容器内温度不再变化,能证明该反应是达到平衡状态,故B正确;
C.断裂1molN≡N键的同时,断裂6molN-H键,正逆反应速率相等,能证明该反应达到平衡状态,故C正确;
D.无论反应是否平衡,反应消耗N2、H2与产生NH3的速率之比1:3:2,不能证明该反应达到平衡状态,故D错误;
故选:BC;

练习册系列答案
相关题目
 4C+2D,其反应速率可以分别用vA、vB、vC、vd(mol·L-1·s-1)表示,则其反应速率正确关系是
4C+2D,其反应速率可以分别用vA、vB、vC、vd(mol·L-1·s-1)表示,则其反应速率正确关系是
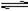 2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/L,在此时间内,用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )
2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol/L,在此时间内,用H2物质的量浓度表示的平均速率为0.45mol/(L·s),则反应所经过的时间为( )