题目内容
将对H2相对密度为3.6 的N2与H2组成的混合气0.5 mol 通入一恒容密闭容器中,一定条件下发生反应,平衡时容器内压强比反应前少了24%。求:
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
(1)7∶2(2)31.6%。
(3)N2、H2的转化率分别为60%和40%。
(3)N2、H2的转化率分别为60%和40%。
这种题首先要利用相对密度求出混合气的平均相对分子量为 7.2,利用十字交叉法求出N2、H2的物质的量比为1∶4,从而得出N2、H2的质量比为 7∶2。然后设未知数列出下列平衡计算模式:
N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
n 0(mol) 0.4 + 0.1 + 0 = 0.5
n变(mol) 3x x 2x
n平(mol) 0.4-3x + 0.1-x + 2x = 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。
N2(g) + 3H2(g)
 2NH3(g)
2NH3(g)n 0(mol) 0.4 + 0.1 + 0 = 0.5
n变(mol) 3x x 2x
n平(mol) 0.4-3x + 0.1-x + 2x = 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
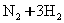

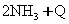 ,下列说法正确的是( )。
,下列说法正确的是( )。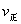 增大,
增大,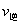 减小,所以平衡向右移动
减小,所以平衡向右移动 2HI(g)(正反应吸热)
2HI(g)(正反应吸热) 2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为( )
2C(g),反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物B浓度的减少来表示该反应的速率为( ) B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是( )
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是( ) 2NH3)的反应速率,其中速率代表同一反应的是( )
2NH3)的反应速率,其中速率代表同一反应的是( )