题目内容
下列化学反应的离子方程式正确的是( )
| A.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑ |
| B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| C.向氯化铝溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
D.向偏铝酸钠溶液中通入过量CO2: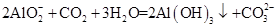 |
B
解析

练习册系列答案
相关题目
25℃时,下列溶液中微粒存在情况合理的是
| A.Fe2+、Mg2+、ClO-、Cl-能大量共存 |
| B.含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 |
C.含K+、Na+、NO3-、CH3COO-的溶液中c(H+)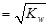 |
| D.硝酸钠和碘化钡混合溶液中,溶质离子浓度为c (Ba2+)=0.2mol/L,c(Na+)=0.2mol/L,c(NO3-)=0.3mol/L,c(I-)=0.1mol/L |
下列离子方程式与所述事实相符且正确的是
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+ |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ |
| D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-离子中的几种。为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰。下列推断正确的是 ( )
| A.肯定有Na+、Al3+、Mg2+、SO42- | B.肯定有Na+、Mg2+、Al3+、HCO3- |
| C.肯定没有K+、HCO3-、MnO4- | D.肯定没有K+、NH4+、Cl- |
下列离子方程式不正确的是( )
| A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
| B.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3—+H+=H2O+CO2↑ |
| C.过量Na投入AlCl3溶液:Al3++4Na+2H2O=AlO2—+4Na++2H2↑ |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++Al3++2SO42—+4OH-=AlO2—+2BaSO4↓+2H2O |
下列反应对应的离子方程式书写正确的是 ( )。
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3— |
| B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO42—+ OH-=BaSO4↓+H2O |
| C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,4OH-+3ClO-+ |
下列离子组在指定溶液中能大量共存的是( )
A.强酸溶液中: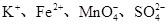 |
B.滴加石蕊试液显红色的溶液中: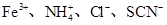 |
C.既能溶解Al(OH)3又能溶解H2SiO3的溶液中: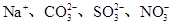 |
D.在含有大量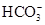 的溶液中 的溶液中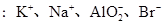 |
下面4组物质,能起反应,且既属于离子反应,又属于氧化还原反应的是( )
| A.Na2SO4溶液和BaCl2溶液 |
| B.铝片与Hg(NO3)2溶液 |
| C.稀硫酸与铜片 |
| D.NaNO3溶液与KCl溶液 |