题目内容
【题目】完成下列与溶液pH有关的计算
(1)室温下pH=2的HCl溶液和pH=10的NaOH溶液中由水电离出的c(H+)之比为____。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为__。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液pH=3,则a:b=___。
(4)已知某温度时0.1molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___(用含a、b的表达式表示)
【答案】1:100 2×10-11 mol·L-1 9:101 a+b=14
【解析】
(1)根据溶液中氢离子与氢氧根离子的实际来源来判断由水电离的c(H+);
(2)先计算混合溶液中c(OH-),再根据Kw=c(OH-)c(H+)计算c(H+);
(3)若所得混合液的pH=3,酸过量,根据c(H+)=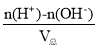 计算;
计算;
(4)某温度时测得0.1molL-1的NaOH溶液的pH为11,则Kw=0.1×10-11=1.0×10-12,混合液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,据此计算。
(1)室温下pH=2的HCl溶液中由水电离出的c(H+)=由水电离出的c(OH-)=溶液中的c(OH-)=![]() =
=![]() =10-12;pH=10的NaOH溶液中由水电离出的c(H+)=溶液中的c(H+)=10-10,则两者之比=10-12:10-10=1:100,故答案为1:100;
=10-12;pH=10的NaOH溶液中由水电离出的c(H+)=溶液中的c(H+)=10-10,则两者之比=10-12:10-10=1:100,故答案为1:100;
(2)在25℃时pH=9的溶液中c(OH)=![]() =105 mol/L,pH=11的溶液中c(OH)=
=105 mol/L,pH=11的溶液中c(OH)=![]() =103 mol/L,则等体积混合溶液中c(OH)=
=103 mol/L,则等体积混合溶液中c(OH)=![]() mol/L,混合溶液中c(H+)=
mol/L,混合溶液中c(H+)=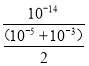 mol/L≈2×1011 mol/L,
mol/L≈2×1011 mol/L,
故答案为:2×1011;
(3)若所得混合液的pH=3,则酸过量,c(H+)=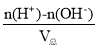 =
=![]() =0.001mol/L,解得a:b=9:101,
=0.001mol/L,解得a:b=9:101,
故答案为:9:101;
(4)因NaOH为强碱,则该溶液中的c(OH-)=0.1molL1,又某温度时测得0.1molL1的NaOH溶液的pH为11,则Kw=0.1×1011=1.0×1012,pH1=a的强酸溶液中氢离子浓度为10a mol/L,pH2=b的强碱溶液中氢氧根离子浓度为10b12 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以100×10a=1×10b12,整理可得a+b=14,
故答案为:a+b=14。