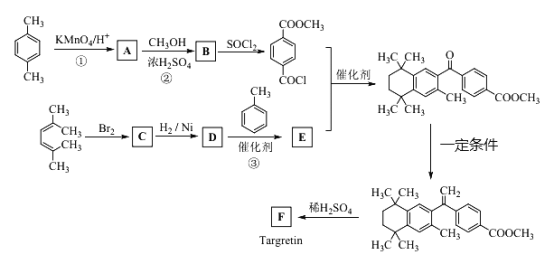
题目内容
【题目】某学习小组设计如下实验装置进行NH3的催化氧化实验。
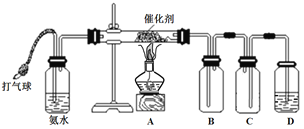
请填写下列空白:
(1)该实验所用的氨水的质量分数为15%,密度为0.94gmL-1,则该氨水的物质的量浓度为___________。实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有_____________ 。
(2)连接好装置后,在D中装入少量水浸没导管口,轻轻向装置中鼓入空气。表示装置气密性良好的现象是________________________________。
(3)实验进行一段时间后,B中出现红棕色。移去酒精灯,催化剂继续保持红热。
①催化剂保持红热的原因是______________________________________。
②氨催化氧化的化学方程式为____________________________________。
(4)加快鼓气速度时,B中会出现白烟。白烟的成分是_________(填化学式)
(5)为获得纯净的NO2,可在装置A与B之间连接____________。
a.盛有碱石灰的干燥管 b.盛有浓硫酸的洗气瓶 c.盛有无水CaCl2的洗气瓶
(6)该实验说明氨的性质有__________________。
【答案】 8.3molL-1 搅拌、引流 D装置的导管口有气泡冒出 NH3催化氧化是放热反应 4NH3 + 5O2![]() 4NO + 6H2O NH4NO3或NH4NO2 b 还原性、碱性、易溶于水等
4NO + 6H2O NH4NO3或NH4NO2 b 还原性、碱性、易溶于水等
【解析】(1)该实验所用的氨水的质量分数为15%,密度为0.94gmL-1,则该氨水的物质的量浓度为c=![]() =
=![]() =8.3mol/L;实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有:稀释浓氨水时搅拌,转移氨水到容量瓶中时引流,故答案为:8.3molL-1;搅拌、引流;
=8.3mol/L;实验室配制该物质的量浓度氨水的过程中玻璃棒的作用有:稀释浓氨水时搅拌,转移氨水到容量瓶中时引流,故答案为:8.3molL-1;搅拌、引流;
(2)连接好装置后,在D中装入少量水浸没导管口,轻轻向装置中鼓入空气,如果装置气密性良好,则在D装置的导管口有气泡冒出,故答案为:D装置的导管口有气泡冒出;
(3)①催化剂保持红热是因为该反应是放热反应,故答案为:NH3催化氧化是放热反应;
②氨催化氧化的化学方程式为4NH3 + 5O2![]() 4NO + 6H2O,故答案为:4NH3 + 5O2
4NO + 6H2O,故答案为:4NH3 + 5O2![]() 4NO + 6H2O;
4NO + 6H2O;
(4)反应过程中生成的一氧化氮被氧化生成二氧化氮,二氧化氮与水蒸气反应生成了硝酸气体,加快鼓气速度时,B中会出现白烟,是过量的氨气与硝酸气体反应生成的NH4NO3,故答案为:NH4NO3;
(5)a.盛有碱石灰的干燥管,会吸收二氧化氮,错误;b.盛有浓硫酸的洗气瓶,会除去未反应的氨气和水蒸气,可以得到纯净的NO2,正确;c.盛有无水CaCl2的洗气瓶可以吸收氨气,但生成物不稳定,受热容易分解,不能保证氨气被吸收干净,错误;故选b;
(6)该实验说明氨发生催化氧化,说明氨气具有还原性,通过向氨水中通入空气会吹出氨气,说明氨气易溶于水,加快鼓气速度时,B中会出现白烟,说明氨气具有碱性,故答案为:还原性、碱性、易溶于水等。