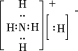题目内容
【题目】炼铁高炉中存在以下热化学方程式:
Ⅰ.C(s) +CO2(g)==2CO(g) ΔH1=+172.5 kJ·mol-1
Ⅱ.Fe2O3(s) +CO(g)![]() 2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
Ⅲ.FeO(s)+CO(g) ![]() Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Ⅳ. Fe2O3(s) +3CO(g) ![]() 2Fe (s)+3CO2(g) ΔH4
2Fe (s)+3CO2(g) ΔH4
(1)上述反应中,ΔH4=__________ kJ·mol-1。
(2)在实际生产中炼铁高炉中通人适量的空气,其主要作用是__________________。
(3)T℃时,在1L的密闭容器中加入20.0g Fe2O3和3.6gC,只发生反应:2 Fe2O3(s) +3C(s) ![]() 4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
(4)炼铁过程中发生反应:2 Fe2O3(s) +3CO(g)![]() 2Fe(s) +3CO2(g)。
2Fe(s) +3CO2(g)。
①下图中能表示该反应的平衡常数对数值(1g K) 与温度的关系的是______(填“Ⅰ”或“Ⅱ”),原因是__________________。

②1500℃时,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3 和CO,则达平衡时Fe2O3的转化率是________。
③下列说法能够提高Fe2O3 的转化率的是________(填字母)。
A.升高反应体系的温度 B.加人适量的Na2O 固体
C.对体系加压 D.增大CO 在原料中的物质的量比
【答案】 -25 与C反应产生热量,制备还原性气体CO 0.005mol·L-1·min-1 Ⅰ 因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小 50% BD
【解析】(1)已知Ⅰ.C(s)+CO2(g)==2CO(g) ΔH1=+172.5kJ·mol-1
Ⅱ.Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
Ⅲ.FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH3=-11kJ·mol-1
Fe(s)+CO2(g) ΔH3=-11kJ·mol-1
根据盖斯定律,由Ⅱ+Ⅲ×2得反应Ⅳ. Fe2O3(s)+3CO(g) ![]() 2Fe (s)+3CO2(g) ΔH4=ΔH2+ΔH3×2=-3kJ·mol-1-11kJ·mol-1×2=-25kJ·mol-1;(2)在实际生产中炼铁高炉中通入适量的空气,其主要作用是与C反应产生热量,制备还原性气体CO;
2Fe (s)+3CO2(g) ΔH4=ΔH2+ΔH3×2=-3kJ·mol-1-11kJ·mol-1×2=-25kJ·mol-1;(2)在实际生产中炼铁高炉中通入适量的空气,其主要作用是与C反应产生热量,制备还原性气体CO;
(3)根据反应2Fe2O3(s)+3C(s) ![]() 4Fe(s)+3CO2(g)
4Fe(s)+3CO2(g) ![]() 固体减少的质量为生成的二氧化碳的质量,即(20.0+3.6-19.2)g=4.4g,物质的量为0.1mol,用CO2表示的反应速率为
固体减少的质量为生成的二氧化碳的质量,即(20.0+3.6-19.2)g=4.4g,物质的量为0.1mol,用CO2表示的反应速率为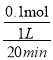 =0.005mol·L-1·min-1;(4)①因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小,图中能表示该反应的平衡常数对数值(1gK)与温度的关系的是Ⅰ;②1500℃时,lgK=0,则K=
=0.005mol·L-1·min-1;(4)①因为该反应正向放热,升高温度,平衡逆向移动,K减小,lgK减小,图中能表示该反应的平衡常数对数值(1gK)与温度的关系的是Ⅰ;②1500℃时,lgK=0,则K= =1,根据反应2 Fe2O3(s)+3CO(g)
=1,根据反应2 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),则参与反应的CO和剩余的CO相等,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3和CO,则达平衡时Fe2O3的转化率与CO的转化率相等,为50%;③反应2 Fe2O3(s)+3C(s)
2Fe(s)+3CO2(g),则参与反应的CO和剩余的CO相等,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3和CO,则达平衡时Fe2O3的转化率与CO的转化率相等,为50%;③反应2 Fe2O3(s)+3C(s) ![]() 4Fe(s)+3CO2(g)是气体体积增大的放热反应,A.升高反应体系的温度,平衡逆向移动,Fe2O3转化率减小,选项A不选;B.加入适量的Na2O固体与二氧化碳反应,平衡正向移动,Fe2O3转化率增大,选项B选;C.对体系加压,平衡向气体体积缩小的逆反应方向移动,Fe2O3转化率减小,选项C不选; D.增大CO在原料中的物质的量比,更多的Fe2O3消耗,转化率增大,选项D选;答案选BD。
4Fe(s)+3CO2(g)是气体体积增大的放热反应,A.升高反应体系的温度,平衡逆向移动,Fe2O3转化率减小,选项A不选;B.加入适量的Na2O固体与二氧化碳反应,平衡正向移动,Fe2O3转化率增大,选项B选;C.对体系加压,平衡向气体体积缩小的逆反应方向移动,Fe2O3转化率减小,选项C不选; D.增大CO在原料中的物质的量比,更多的Fe2O3消耗,转化率增大,选项D选;答案选BD。

【题目】沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验:
步 骤 | 现 象 |
Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 | 产生白色沉淀。 |
Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 | 白色沉淀变为黑色。 |
Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 | 沉淀由黑色最后完全变为乳白色。 |
回答下列问题:
(1)Ⅰ中的白色沉淀是__________。
(2)写出Ⅱ中沉淀变黑的离子方程式__________ ,沉淀转化的主要原因是______________。
(3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀;
ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。
① 由ⅰ判断,滤液X中被检出的离子是_______。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。
(4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。
装置 | 实验结果 |
B | 一段时间后,出现乳白色沉淀 |
C | 一段时间后,无明显变化 |
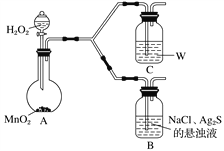
①A中,盛有MnO2的玻璃仪器名称是_________________。
②C中盛放的是物质W的悬浊液,W是________(填化学式)。
③请完成B中发生反应的反应式并配平:_____
Ag2S+ + + H2O![]() AgCl+ + NaOH
AgCl+ + NaOH
________