题目内容
【题目】等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
A.金属铝均剩余
B.金属铝均溶解
C.盐酸中铝剩余,而氢氧化钠中铝全部溶解
D.氢氧化钠这铝剩余,而盐酸中铝全部溶解
【答案】D
【解析】解:A.若盐酸、NaOH少量,则Al均有剩余,故A不选;
B.若酸碱均足量,Al均溶解,故B不选;
C.由2Al~6HCl~2NaOH可知,与等量酸碱反应时,酸不足、碱过量,则盐酸中铝剩余,而氢氧化钠中铝全部溶解,故C不选;
D.结合选项C可知,NaOH中Al不会剩余,故D选;
故选D.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】
(1)下列关于实验的叙述中正确的有__________。
A.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
B.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
C.使用分液漏斗前要检查其是否漏水 |
D.用托盘天平称量物质质量时,物品应置于右盘 |
E.可燃性气体点燃前一定要验纯
F.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
(2)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);
分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置__________,该分离方法的名称为______________。
②从碘水中分离出I2,选择装置__________,该分离方法的名称为__________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在 (填“上层”或“下层”)液体中,该层溶液颜色为__________。
③装置A中①的名称是__________,进水的方向是从___________(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作 。
【题目】1 000mL某待测液中除含有0.2mol,L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
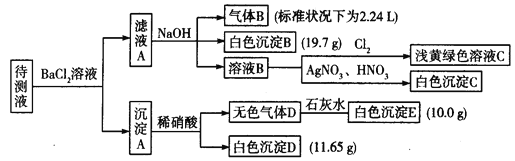
(1)写出生成白色沉淀B的离子方程式:__________________
(2)待测液中肯定不存在的阳离子是____________。
(3)若无色气体D是单一气体:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol.L — | ____ | ____ | ____ | ____ | ____ | ____ |
将阴离子的物质的量浓度填入上表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______________
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是______________。
②沉淀A中能与稀硝酸反应的成分是_______________(写化学式)。