题目内容
【题目】反应:aA(g)+bB(g) ![]() cC(g)+dD(g)
cC(g)+dD(g)![]() H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
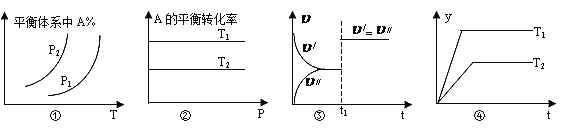
A. 图①中,若p1>p2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则![]() H<0且a+b=c+d
H<0且a+b=c+d
C. 图③中(υ/表示正反应速率,υ//表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
D. 图④中,若![]() H<0,则纵坐标不可能表示的是反应物的转化率
H<0,则纵坐标不可能表示的是反应物的转化率
【答案】C
【解析】试题分析:A. 图①中,若P1>P2,增大压强,平衡体系中A的百分含量减小,说明平衡正向移动,增大压强,平衡向系数减小的方向进行,则该反应是熵减的可逆反应,该反应在较低温度下有利于自发进行,A项正确;B. 图②中,若T2>T1,升高温度,A的平衡转化率降低,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动,则其正反应为放热反应,![]() H<0,增大压强,平衡不移动,所以该反应是气体体积不发生变化的可逆反应,则a+b=c+d,B项正确;C.对于气体体积不发生变化的可逆反应,增大压强,加快了化学反应速率但平衡不移动,在图③中,t1时刻改变的条件可能是使用了催化剂或增大了压强,C项错误;D.图④中,若
H<0,增大压强,平衡不移动,所以该反应是气体体积不发生变化的可逆反应,则a+b=c+d,B项正确;C.对于气体体积不发生变化的可逆反应,增大压强,加快了化学反应速率但平衡不移动,在图③中,t1时刻改变的条件可能是使用了催化剂或增大了压强,C项错误;D.图④中,若![]() H<0,根据“先拐先平,温高压大”, T2<T1,升高温度,平衡逆向移动,反应物的转化率降低,则纵坐标不可能表示的是反应物的转化率,D项正确;选C。
H<0,根据“先拐先平,温高压大”, T2<T1,升高温度,平衡逆向移动,反应物的转化率降低,则纵坐标不可能表示的是反应物的转化率,D项正确;选C。

【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
实验 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 .
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=).


