题目内容
向容积相同的甲、乙密闭容器中投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g) 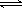 2NH3(g) ΔH=-92.4 kJ·mol
2NH3(g) ΔH=-92.4 kJ·mol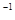 ):
):
下列说法正确的是( )
A.c1 = c2 B.a + b =" 1" C.p1>p2 D.α1 +α2>1
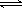 2NH3(g) ΔH=-92.4 kJ·mol
2NH3(g) ΔH=-92.4 kJ·mol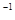 ):
):| | 反应物投入量 | NH3的浓度 (mol·L 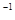 ) ) | 反应的 能量变化 | 体系压强 (Pa) | 反应物 转化率 |
| 甲 | 1mol N2、3mol H2 | c1 | 放出a kJ | p1 | α1 |
| 乙 | 2mol NH3 | c2 | 吸收b kJ | p2 | α2 |
下列说法正确的是( )
A.c1 = c2 B.a + b =" 1" C.p1>p2 D.α1 +α2>1
A
试题分析:甲从正反应方向开始,乙从逆反应方向开始,由于反应条件相同,容器的容积相等,物质一边倒转化后的物质的量相同,因此达到平衡时二者为等效平衡。因此达到平衡时c1 = c2。A正确。能量转化关系是a+b=92.4 kJ/mol。B错误。由于是等效平衡,所以反应达到平衡水体系的压强相等。即p1=p2 。错误。当可逆反应从正反两个相反的方向开始发生时,反应物的转化率互为倒数关系。即α1 ·α2=1。错误。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
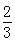 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )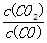
 2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是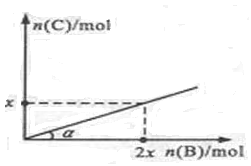
 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
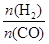 ]:当γ=2时,甲醇的选择性[λ =
]:当γ=2时,甲醇的选择性[λ =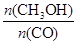 ]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。
]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。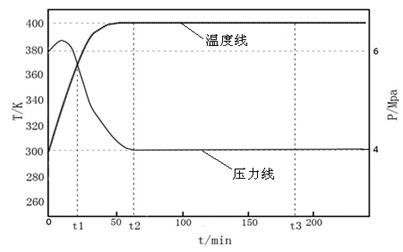
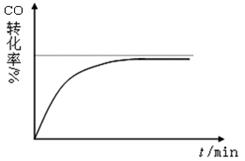
 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是: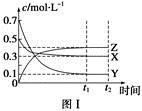
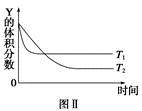
 2Z(g) ΔH>0
2Z(g) ΔH>0