题目内容
【题目】黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:

(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是____。
(2)反应②中还原剂是________。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
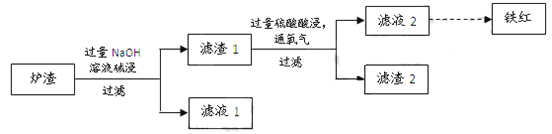
① 炉渣碱浸时反应的离子方程式是_____、_____。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是________;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中_________。
【答案】-2 Cu2S SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O 4FeO+O2+12H+=4Fe3++6H2O 再滴入2~3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全
【解析】
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中Cu、Fe的化合价都为+2价,根据化合物中元素的正负化合价代数和为0,其中硫元素的化合价是-2价;
(2)反应②中,O元素的化合价由0价降至-2价,O2为氧化剂,Cu2S中Cu元素的化合价由+1价降低至0价,硫元素的化合价由-2价升高到+4价,被氧化,Cu2S既作还原剂又作还原剂,还原剂是Cu2S;
(3)①炉渣中加入过量氢氧化钠溶液,SiO2、Al2O3溶于NaOH溶液,反应的离子方程式是SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;②滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是,4FeO+O2+12H+=4Fe3++6H2O;为检验铁元素是否被完全氧化,可检验滤液2中是否含有Fe2+,由于滤液2中含Fe3+,所以应利用Fe2+的还原性检验,应进行的实验操作是:取少量滤液2于试管中,再滴入2~3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。