题目内容
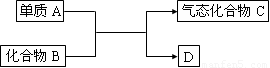
 如图是一些重要工业生产的转化关系(反应条件略去):
如图是一些重要工业生产的转化关系(反应条件略去):请完成下列问题:
(1)若D是单质,且与A属于同一主族,则.
①反应的化学方程式是
2C+SiO2
2CO+Si
| ||
2C+SiO2
2CO+Si
.
| ||
②D的原子结构示意图是


③D单质的一种重要用途是
制半导体材料
制半导体材料
.(2)若B为黄色固体,D为固体化合物,则
①该反应的化学方程式是
4FeS2+11O2
2Fe2O3+SO2↑
| ||
4FeS2+11O2
2Fe2O3+SO2↑
.
| ||
②生产该工业品的工厂应建在离
消费中心
消费中心
较近的地方.③实验室检验C的方法是
将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色
将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色
.(3)若B是一种有刺激性气味的气体,则
①B的分子形状是
三角锥形
三角锥形
.②实验室进行此实验时,常看到有大量白烟产生,请说明产生大量白烟的原因
生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟
生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟
.③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的
| 2 |
| 3 |
3NO=NO2+N2O
3NO=NO2+N2O
.分析:(1)根据常见的置换反应,A、D同主族及工业制取硅的化学反应分析.
(2)根据B为黄色固体,D为固体化合物及工业生产硫酸的原理思考.
(3)根据工业氨气催化氧化制取硝酸分析.
(2)根据B为黄色固体,D为固体化合物及工业生产硫酸的原理思考.
(3)根据工业氨气催化氧化制取硝酸分析.
解答:解:(1)D与A同主族,A能置换出D,且该反应是重要反应,则分析元素周期表,可知A是C,D是Si,即2C+SiO2
2CO+Si.Si的原子结构示意图是  ,硅单质的一种重要用途是制半导体材料,故答案为:2C+SiO2
,硅单质的一种重要用途是制半导体材料,故答案为:2C+SiO2
2CO+Si; ;制半导体材料;
;制半导体材料;
(2)①化合物B为黄色固体,中学阶段的黄色固体化合物有AgI、硫铁矿等,能用于工业生产的只能是用黄铁矿生成浓硫酸,即A是氧气,B是FeS2,C是SO2,因此化学方程式为4FeS2+11O2
2Fe2O3+SO2,故答案为:4FeS2+11O2
2Fe2O3+SO2↑;
②该反应用于工业生产硫酸,由于浓硫酸是腐蚀品,运输成本较高,且危险性大,因此建厂时应该选择在使用浓硫酸密集的地方,即工业区集中的消费中心,故答案为:消费中心;
③因为氯气和二氧化硫都能使品红试液褪色,所以利用二者化学性质的差别,实验室检验二氧化硫通常采用:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色,
故答案为:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色;
(3)①该反应为工业生产的转化关系,又实验室做该实验有白烟,结合中学阶段氨气与挥发性酸相遇会产生白烟的知识,可知该反应是工业上氨气催化氧化制取硝酸的反应,即
4NH3+5O2
4NO+6H2O,因此B是NH3,C是NO.氨气分子是三角锥形,故答案为:三角锥形;
②实验室进行此反应,NO会被过量氧气氧化为NO2,进而与水反应生成硝酸,硝酸与氨气反应生成硝酸铵而产生大量白烟,即:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟,故答案为:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟;
③NO在密闭容器中一定条件下可以分解为二氧化氮和一氧化二氮,发生的反应为3NO=NO2+N2O,由于存在2NO2?N2O4而容器内气体的压强略小于原来的
.
故答案为:3NO=NO2+N2O.
| ||
 ,硅单质的一种重要用途是制半导体材料,故答案为:2C+SiO2
,硅单质的一种重要用途是制半导体材料,故答案为:2C+SiO2
| ||
 ;制半导体材料;
;制半导体材料;(2)①化合物B为黄色固体,中学阶段的黄色固体化合物有AgI、硫铁矿等,能用于工业生产的只能是用黄铁矿生成浓硫酸,即A是氧气,B是FeS2,C是SO2,因此化学方程式为4FeS2+11O2
| ||
| ||
②该反应用于工业生产硫酸,由于浓硫酸是腐蚀品,运输成本较高,且危险性大,因此建厂时应该选择在使用浓硫酸密集的地方,即工业区集中的消费中心,故答案为:消费中心;
③因为氯气和二氧化硫都能使品红试液褪色,所以利用二者化学性质的差别,实验室检验二氧化硫通常采用:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色,
故答案为:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色;
(3)①该反应为工业生产的转化关系,又实验室做该实验有白烟,结合中学阶段氨气与挥发性酸相遇会产生白烟的知识,可知该反应是工业上氨气催化氧化制取硝酸的反应,即
4NH3+5O2
| ||
| △ |
②实验室进行此反应,NO会被过量氧气氧化为NO2,进而与水反应生成硝酸,硝酸与氨气反应生成硝酸铵而产生大量白烟,即:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟,故答案为:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟;
③NO在密闭容器中一定条件下可以分解为二氧化氮和一氧化二氮,发生的反应为3NO=NO2+N2O,由于存在2NO2?N2O4而容器内气体的压强略小于原来的
| 2 |
| 3 |
故答案为:3NO=NO2+N2O.
点评:本题是中学工业生成的合成题目,综合性强,难度大,需要具有非常扎实的基础知识和灵活运用知识的能力,因此要能熟练地解答此类题目,平时学习时要多总结,多积累.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
 2Fe2O3+8SO2
2Fe2O3+8SO2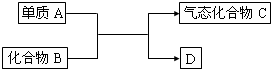 如图是一些重要工业生产的转化关系(反应条件略去):
如图是一些重要工业生产的转化关系(反应条件略去):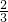 ,请写出该反应的化学方程式______.
,请写出该反应的化学方程式______.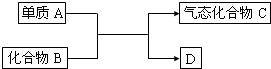
 ,请写出该反应的化学方程式 .
,请写出该反应的化学方程式 .