题目内容
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示: 
(1)请列举海水淡化的一种方法 .
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、、 .
(3)步骤Ⅰ中已经获得Br2 , 步骤Ⅱ中又将获得的Br2还原为Br﹣ , 其目的是
(4)步骤Ⅱ用SO2水溶液吸收Br2 , 吸收率可达95%,该反应的离子方程式为 . 由此反应可知,除保护环境外,在工业生产中还应解决的问题是 .
【答案】
(1)蒸留法或电渗透法或离子交换法等
(2)NaOH;Cl2
(3)富集溴元素
(4)SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀
【解析】解:(1)目前淡化海水的方法有多种,如:蒸留法、电渗透法、离子交换法、水合物法、溶剂萃取法和冰冻法;所以答案是:蒸留法或电渗透法或离子交换法等;(2)电解饱和食盐水生成氢气、氯气、氢氧化钠,2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:NaOH;Cl2;(3)步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,所以答案是:富集溴元素;(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣ , 工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,所以答案是:SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀.
2NaOH+Cl2↑+H2↑,所以答案是:NaOH;Cl2;(3)步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,所以答案是:富集溴元素;(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣ , 工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,所以答案是:SO2+Br2+2H2O═4H++2Br﹣+SO42﹣;强酸对设备的严重腐蚀.

【题目】不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
第二周期 | Li | Be | B | C | N | O | F |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
第三周期 | Na | Mg | Al | Si | P | S | Cl |
电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值的变化规律,确定N、Mg的x值的范围:<x(Mg)< , <x(N)< .
(2)推测x值与原子半径的关系是 . 根据短周期元素x值变化特点,体现了元素性质的变化规律.
(3)某有机物结构简式如图,其中C﹣N中,你认为共用电子对偏向原子(填原子名称). 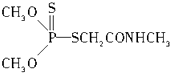
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为
(5)预测元素周期表中x值最小的元素是(填元素符号,放射性元素除外).