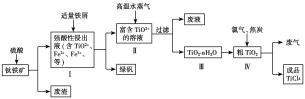
题目内容
【题目】将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaoH溶液的体积关系如下图所示。 若不考虑金属和盐酸反应时HCI的挥发,则下列说法不正确的是( )
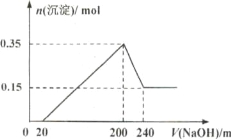
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为10 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D .生成的氢气在标准状况下的体积为11.2 L
【答案】D
【解析】
试题分析:根据反应的先后顺序H++OH-=H2O,Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Al(OH)3+OH-=AlO2-+2H2O,氢氧化镁物质的量为0.15mol,则氢氧化铝的物质的量为(0.35-0.15)mol=0.2mol,A、根据元素守恒,合金的质量为(0.15×24+0.2×27)g=9g,故说法正确;B、200-240mL之间发生反应是Al(OH)3+OH-=AlO2-+2H2O,则c(NaOH)=0.2/(240-200)×10-3mol/l=5mol·L-1,加入200mL的NaOH,沉淀达到最大,溶质为NaCl,根据元素守恒,n(NaCl)=n(NaOH)=n(HCl)=200×10-3×5mol=1mol,c(HCl)=1/100×10-3mol·L-1=10mol·L-1,故说法正确;C、根据上述分析,故说法正确;D、 根据得失电子数目守恒,即0.15×2+0.2×3=V(H2)×2/22.4,解得V(HCl)=10.08L,故说法错误。

练习册系列答案
相关题目