题目内容
16.下列有关说法错误的是( )| A. | NA个OH-含有电子10mol | |
| B. | 某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA | |
| C. | 4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA | |
| D. | 配制一定物质的量浓度的NaOH溶液时,定容时俯视操作所得溶液浓度偏低 |
分析 A.1个氢氧根离子含有10个电子;
B.摩尔质量以g/mol时,数值上与相对原子质量相同;
C.依据n=CV计算氢氧化钠的物质的量,结合1mol氢氧化钠含有1mol氢氧根离子解答;
D.俯视操作所得溶液体积偏小.
解答 解:A.NA个OH-的物质的量为1mol,含有电子10mol,故A正确;
B.某元素R一个原子的质量是ag,则其摩尔质量为a NAg/mol,相对原子质量可表示为a NA,故B正确;
C.4L0.5mol/L的NaOH溶液,含氢氧化钠物质的量为4L×0.5mol/L=2mol,含有阴离子的数目为2NA,故C正确;
D.俯视操作所得溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高,故D错误;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟悉以物质的量为中心的相关公式,明确摩尔质量的概念是解题关键,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
6.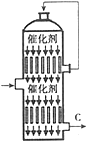 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
(3)接触室内有一热交换器,其作用是预热原料气,吸收反应放出的热量,若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式)SO3+Ba2++H2O=BaSO4↓+2H+;
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.
 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.
7.如图是298K 时N2与H2反应过程中能量变化的曲线图.下列叙述不正确的是( )
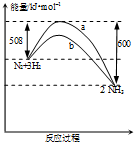

| A. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ•mol-1 | |
| D. | 在温度、体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,则Q1<92 |
4.下列溶液中各微粒的浓度关系正确的是( )
| A. | pH=4的盐酸中:c(H+)=4.0mol•L-1 | |
| B. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| C. | NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
11.下列实验基本操作(或实验注意事项)中,主要不是从实验安全角度考虑的是( )
| A. | 酒精灯内的酒精用量一般不超过其容积的$\frac{2}{3}$,也不少于其容积的$\frac{1}{4}$ | |
| B. | 用氢气还原氧化铜时,应先通入氢气一会儿,然后再点燃酒精灯加热 | |
| C. | 实验室用高锰酸钾制取氧气结束时,应先将导管从水中取出,然后再停止加热 | |
| D. | 在分液操作中,应将上层液体从分液漏斗的上口倒出 |
8.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 32g甲醇中含有C-H键的数目为4NA | |
| B. | 60g熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | Na2O2与足量H2O反应产生0.2mol O2,转移电子的数目为0.4NA | |
| D. | 惰性电极电解食盐水,当线路中通过电子数为NA时,阳极产生气体11.2L |
5.下列叙述正确的是( )
| A. | 乙醇能使酸性KMn04溶液和酸性K2Cr207溶液褪色,均被氧化成乙酸 | |
| B. | 向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小 | |
| C. | 向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在S042-或S032- | |
| D. | 实验室提纯混有少量氯化钠的硝酸钾,通常采用重结晶的方法 |
6.能区分胶体和溶液的方法是( )
| A. | 静置,有沉淀现象的是胶体 | B. | 能透过滤纸的是溶液 | ||
| C. | 用肉眼观察,均匀透明的是溶液 | D. | 有丁达尔现象的是胶体 |