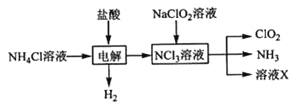
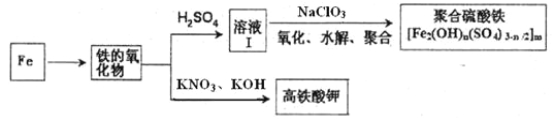
题目内容
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
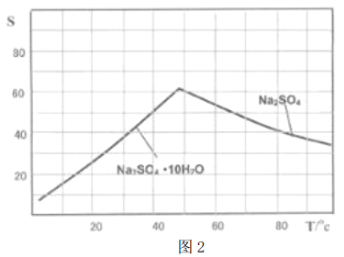
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
【答案】(1)60%;(2)2H2SO4;S;2H2O;
(3)将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)趁热过滤,防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO4·10H2O晶体;
(5)MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;(6)Zn
Zn+MnO2+2H2SO4;(6)Zn
【解析】
试题分析:(1)已知2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4、I2+2 S2O32-=2I-+ S4O62-,则
MnO2~I2~2S2O32﹣
1 2
n 0.1000molL﹣1×0.050L
解得n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×1000/25=0.1mol
则软锰矿中MnO2含量=![]() ;
;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4、MnSO4和硫单质,根据原子守恒和电子得失守恒可知反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁,反应的离子方程式为:Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)图像分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物;
(5)根据流程图中得到产物为二氧化锰和锌可知得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e﹣=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+﹣2e﹣+2H2O=MnO2+4H+,所以反应的化学方程式为MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;
Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2。

 阅读快车系列答案
阅读快车系列答案