题目内容
12.有A、B、C、D四种元素,A元素形成的离子中只有一个质子,B原子的最外层电子数是次外层的3倍,C元素的一价阳离子核外有10个电子,D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子.回答下列问题:(1)画出D元素的离子结构示意图
 ;C2B2的电子式为
;C2B2的电子式为 .
.(2)由B、C、D三种元素组成的化合物中含有的化学键有离子键、共价键.
(3))A和B可形成电子数相同的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式:H3O++OH-═2H2O.
分析 有A、B、C、D四种元素,A元素形成的离子中只有一个质子,A为H;B原子的最外层电子数是次外层的3倍,B只有2个电子层符合电子排布规律,最外层电子数为6,则B为O;C元素的一价阳离子核外有10个电子,C的质子数为10+1=11,C为Na;D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子,D的质子数为18-1=17,D为Cl,以此来解答.
解答 解:由上述分子可知,A为H,B为O,C为Na,D为Cl,
(1)D元素的离子结构示意图为 ,C2B2的电子式为
,C2B2的电子式为 ,故答案为:
,故答案为: ;
; ;
;
(2)由B、C、D三种元素组成的化合物为NaClO,含离子键、共价键,故答案为:离子键、共价键;
(3)A和B可形成电子数相同的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式为H3O++OH-═2H2O,故答案为:H3O++OH-═2H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、电子排布来推断元素为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
3.下列表示离子化合物形成过程的电子式正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
7.下列元素的原子半径最大的是( )
| A. | 氯 | B. | 硫 | C. | 氧 | D. | 氢 |
4.下列表示正确的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| B. | CO(g)的燃烧热是283.0kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=-566.0kJ•mol-1 | |
| C. | 含有大量AlO2-的溶液中:K+、CO32-、Br-、NH4+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32- |
1.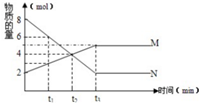 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
9.化学是一门实用性很强的科学,与社会、环境等密切相关.下列说法错误的是( )
| A. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| B. | 用NH4Cl浓溶液除铁锈,因为NH4 Cl水解显酸性 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| D. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 |

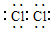 ,M的学化式为NaClO.
,M的学化式为NaClO. ,请回答下列问题.
,请回答下列问题. .
.