题目内容
2.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.M与X同主族,与W同周期.(1)M元素是Na(填元素符号).
(2)Z、W形成的气态氢化物的稳定性为H2O>H2S(填化学式).
(3)M2Z2的电子式为
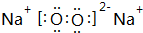 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.(4)由X、Y、Z、W四种元素中的三种组成的-种强酸,该强酸的稀溶液能与铜反应,离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体;
②A能与盐酸反应产生气体B,该气体能与氯水反应.
则A是(NH4)2SO3(填化学式);写出该气体B与氯水反应的离子方程式:SO2+Cl2+2H2O=4H++2Cl-+SO42-.
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na,
(2)非金属性越强,氢化物越稳定;
(3)Na2O2由钠离子与过氧根离子构成,与水反应生成NaOH与氧气;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水;
(5)由H、N、O、S四种元素组成的一种离子化合物A,为铵盐.
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;②A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为亚硫酸铵,二氧化硫有氯水反应得到HCl与硫酸.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na,
(1)由上述分析可知,M为Na元素,
故答案为:Na;
(2)非金属性O>S,非金属性越强,对应氢化物越稳定,则氢化物稳定性大小为:H2O>H2S,
故答案为:H2O;H2S;
(3)Na2O2由钠离子与过氧根离子构成,电子式为: ,与水反应生成NaOH与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
,与水反应生成NaOH与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为: ;2Na2O2+2H2O=4Na++4OH-+O2↑;
;2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由H、N、O、S四种元素组成的一种离子化合物A,为铵盐.
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;②A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为(NH4)2SO3,二氧化硫有氯水反应得到HCl与硫酸,反应离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案为:(NH4)2SO3;SO2+Cl2+2H2O=4H++2Cl-+SO42-.
点评 本题综合考查位置结构性质关系,题目难度中等,明确元素的种类为解答该题的关键,注意掌握相关物质的性质,侧重于物质的性质以及化学式的推断,注意把握相关实验现象.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案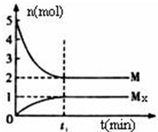 E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的主族元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下转化关系:aM(g)?bMx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A. | 平衡时混合气体的平均摩尔质量是33.3g/mol | |
| B. | t1时刻,保持温度不变,再充入5molM,重新达到平衡时,c(Mx)/c(M)将减小 | |
| C. | 该反应的化学方程式是2HF?(HF)2 | |
| D. | M的沸点比同主族下一周期元素的气态氢化物沸点低 |
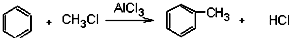 ,苯和下列各组物质合成乙苯最好应选用的是( )
,苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |
| A. | 放热反应在常温下一定很容易发生 | |
| B. | 化学反应一定既伴随着物质变化又伴随着能量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
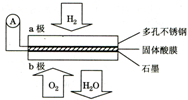
| A. | a极为负极,工作过程中a极附近酸性增强 | |
| B. | 电池总反应可表示为:2H2+O2=2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1mol电子,消耗标准状况下2.24L H2 |
| A. | 油脂是植物油和动物脂肪的统称,分子的不饱和程度越大,熔点越低 | |
| B. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应,是两性氧化物 | |
| C. | 石油经裂化得到的汽油可用来萃取溴水中的Br2 | |
| D. | 麻黄碱(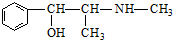 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 |
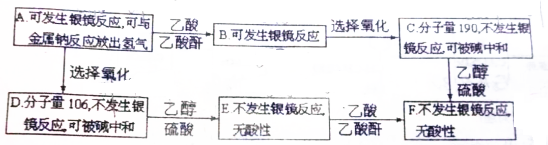
 .
.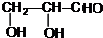 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$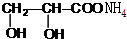 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.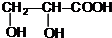 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$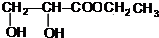 +H2O,属于取代反应(填反应类型).
+H2O,属于取代反应(填反应类型).
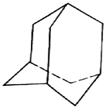 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: