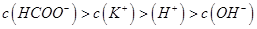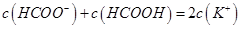题目内容
下列说法正确的是( )
| A.25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw |
| B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O====SO32―+2I―+4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- |
| D.100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
C
A项,水的离子积Kw仅是温度的函数,温度越高,Kw越大,与溶液中的溶质无关,A错误;B 项,I2具有较强氧化性,能将SO2氧化,正确的离子方程式是SO2+I2+2H2O====SO42-+4H++2I-,B错误;C项,加入铝粉能产生氢气的溶液可能是强碱性溶液,也可能是酸性溶液,若是强碱性溶液,Na+、Ba2+、AlO2-、NO3-可以大量共存,正确;D项,100 ℃时,Kw=1.0×10-12,pH=2的盐酸c(H+)="0.01" mol/L, pH=12的NaOH溶液c(OH-)="1" mol/L,若等体积混合溶液显碱性,D错误。

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目


 >1
>1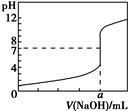
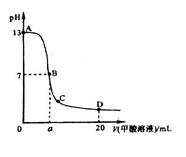
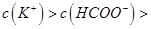
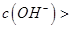
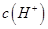
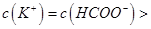
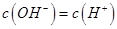 ,且a=7.5
,且a=7.5