题目内容
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
| A.元素X在周期表中的位置为第2周期ⅥA族 |
| B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol |
C
解析试题分析:常温下0.01 mol·L-1丁溶液的pH为12,可知丁为一元强碱,应为NaOH,根据己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己,可推出甲为Na2O2、乙为H2O、己为O2、丙为CO2、戊为Na2CO3,则W、X、Y、Z分别为H、C、O、Na元素。A、X为C元素,在周期表中的位置为第2周期IVA族,错误;B、原子半径r(Na)>r(C)>r(O),即r(Z)> r(X) > r(Y),错误;C、根据化合价的变化可知,Na2O2的电子转移为:Na2O2 ~ e?,所以1 mol Na2O2与足量的H2O完全反应转移的电子数为6.02×1023,正确;D、Na2CO3为弱酸强碱盐,CO32?发生水解反应,CO32?+H2O
戊+己,可推出甲为Na2O2、乙为H2O、己为O2、丙为CO2、戊为Na2CO3,则W、X、Y、Z分别为H、C、O、Na元素。A、X为C元素,在周期表中的位置为第2周期IVA族,错误;B、原子半径r(Na)>r(C)>r(O),即r(Z)> r(X) > r(Y),错误;C、根据化合价的变化可知,Na2O2的电子转移为:Na2O2 ~ e?,所以1 mol Na2O2与足量的H2O完全反应转移的电子数为6.02×1023,正确;D、Na2CO3为弱酸强碱盐,CO32?发生水解反应,CO32?+H2O 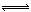 HCO3?+OH?,阴离子的物质的量增多,所以1.0 L0.1 mol·L-1戊溶液阴离子的总物质的量大于0.1 mol,错误。
HCO3?+OH?,阴离子的物质的量增多,所以1.0 L0.1 mol·L-1戊溶液阴离子的总物质的量大于0.1 mol,错误。
考点:本题考查元素的推断、原子半径比较、电子转移、盐类的水解。

 阶梯计算系列答案
阶梯计算系列答案下列事实中,能说明氯的非金属性比硫强的是
| A.高氯酸的酸性比亚硫酸强 | B.次氯酸的氧化性比稀硫酸强 |
| C.氯化氢比硫化氢的热稳定性好 | D.氯原子最外层电子数比硫原子多 |
硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的物质的量之比为( )
| A.1∶4 | B.1∶2 | C.1∶1 | D.1∶3 |
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.元素Z、W的简单离子的电子层结构不同 |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
下列粒子中,与NH4+具有相同质子数和电子数的是
| A.OH— | B.F- | C.Na+ | D.NH3 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
下列关于元素的叙述正确的是( )
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
下列说法正确的是( )
| A.第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B.L层电子数为奇数的所有元素都是非金属元素 |
| C.ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D.同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |