题目内容
下列对分子或离子的立体构型判断不正确的是 ( )。
| A.NH4+和CH4都是正四面体形 |
| B.CO2和CS2都是直线形 |
| C.NCl3和BCl3都是三角锥形 |
| D.H2O和H2S都是V形 |
C
解析

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
下列物质的变化过程中,只需克服分子间作用力的是( )
| A.食盐溶解 | B.氯化氢溶于水 | C.干冰升华 | D.氯化铵分解 |
研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是
| A.羰基硫分子为非极性分子 | B.羰基硫的电子式为: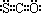 |
| C.羰基硫沸点比CO2高 | D.羰基硫分子中三个原子处于同一直线上 |
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。下列对NCl3的有关描述正确的是( )
| A.NCl3是三角锥形结构,故它是非极性分子 |
| B.NCl3分子间可形成氢键,故它比PCl3难挥发 |
| C.NCl3有孤电子对,它还能以配位键的形式再与一个Cl-结合 |
| D.NCl3分子中不存在非极性共价键 |
美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是( )
| A.分子间作用力 | B.氢键 |
| C.非极性共价键 | D.极性共价键 |
下列说法正确的是( )
| A.N2、CS2、H2O、CH4都是非极性分子 |
| B.SiO2、CsCl、HCl、HF四种晶体的熔点逐渐降低 |
| C.CO2、PCl3、CCl4、CH4四种分子中,各原子都满足最外层8电子结构 |
| D.由原子序数为1和8、1和6的元素,可分别形成原子数之比为1:1的化合物 |
固体A的化学式为NH5,它的所有原子的最外层电子结构都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔沸点高于NH3 |
| C.1 mol NH5中含有5 mol N—H键 |
| D.将固体A投入少量水中,可生成H2和NH3·H2O |
下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性键和非极性键的是( )。
| A.Na | B.Mg | C.Ne | D.Cl |
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成。下列关于氢化铵叙述不正确的是( )。
| A.是离子化合物,含有离子键和共价键 |
B.电子式是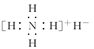 |
| C.与水反应时,是还原剂 |
| D.固体投入少量的水中,有两种气体产生 |