题目内容
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。下列对NCl3的有关描述正确的是( )
| A.NCl3是三角锥形结构,故它是非极性分子 |
| B.NCl3分子间可形成氢键,故它比PCl3难挥发 |
| C.NCl3有孤电子对,它还能以配位键的形式再与一个Cl-结合 |
| D.NCl3分子中不存在非极性共价键 |
D
解析

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列说法中不正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键 |
| C.共价化合物中不可能存在离子键 |
| D.某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键 |
以下说法正确的是( )
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
(双选)下列电子式有误的是( )。
A.氯原子∶ · · | B.硫离子 | C.溴离子[∶Br∶]- | D.钙离子Ca2+ |
物质之间发生反应时,一定发生变化的是( )。
| A.颜色 | B.状态 | C.化学键 | D.原子核 |
XY2是离子化合物,X和Y离子电子层结构都与氖原子相同,则X、Y分别为( )。
| A.Ca和Cl | B.K和S | C.Ca和F | D.Mg和F |
下列推断正确的是( )
| A.BF3是三角锥形分子 |
B.NH4+的电子式: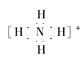 ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—Hσ键 |
下列对分子或离子的立体构型判断不正确的是 ( )。
| A.NH4+和CH4都是正四面体形 |
| B.CO2和CS2都是直线形 |
| C.NCl3和BCl3都是三角锥形 |
| D.H2O和H2S都是V形 |
下列各组物质中,都是由极性键构成的极性分子的一组是( )。
| A.CH4 Br2 | B.H2O NH3 |
| C.CCl4 H2S | D.CO2 HCl |