题目内容
化学与生活、生产息息相关,下列说法不正确的是
| A.煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 |
| B.测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
| C.利用盐类的水解反应可以制备胶体对饮用水进行净化,也可以获得纳米材料 |
| D.通常条件下能够自发进行的反应必须具备△H和△S均小于零 |
D
解析试题分析:D.通常条件下能够自发进行的反应必须具备△H<0和△S>0,D错误。
考点:化学与生活、生产的关系。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
已知: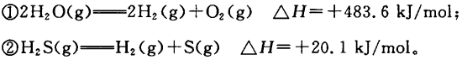
下列判断正确的是 ( )
| A.氢气的燃烧热:△H="-241.8" kJ/mol |
| B.相同条件下,充分燃烧1 mol H2(g)与1 molS(g)的混合物比充分燃烧1 molH2S (g)放热多20.1 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.②中若生成固态硫,△H将增大 |
下列说法或表示方法中正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH=" -1.9KJ/mol" 可知,金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH=" —53.7KJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q |
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+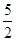 O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+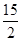 O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
| A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ |
| B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
下列反应属于放热反应的是( )
①稀硫酸与氢氧化钾溶液反应
②锌与稀硫酸的反应
③生石灰变成熟石灰的反应
④氢氧化钡晶体和氯化铵晶体混合反应
⑤石灰石高温煅烧
⑥灼热的炭与CO2反应
⑦甲烷与O2的燃烧反应
| A.①②③⑤ | B.①②③⑦ |
| C.①②⑤⑥⑦ | D.④⑥ |
100 g炭粉燃烧所得气体中,CO占 、CO2占
、CO2占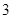 ,且C(s)+
,且C(s)+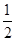 O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+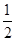 O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
| A.784.92 kJ | B.2 489.44 kJ | C.1 569.83 kJ | D.3 274.3 kJ |
(2013·广东中山一模,11)下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |