题目内容
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
【答案】AC
【解析】
A. 化学反应中Mn的化合价由+4变为+2价,得2个电子,Cl的化合价由-1变为0价,失去2个电子,则电子转移的表示方法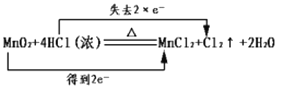 ,符合题意,A正确;
,符合题意,A正确;
B. 离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,反应中转移6个电子,则M2O7x-中M的化合价为+6,与题意不符,B错误;
C. 氧化性:氧化剂>氧化产物,则在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O,氧化性:XO4-> Z2;②2A2++B2=2A3++2B-氧化性:B2 > A3+;③2B-+Z2 =B2+2Z-氧化性:Z2 > B2;根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+,符合题意,C正确;
D. 已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为5:3,与题意不符,D错误;
答案为AC。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
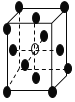
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |