题目内容
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
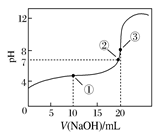

| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
C
试题分析:点①处醋酸过量。根据电荷守恒可知,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),A不正确;点②所示溶液显中性,醋酸还是过量的,根据电荷守恒可知c(Na+)=c(CH3COO-),B不正确;当加入的氢氧化钠很少时,选项C中的关系是存在的,C正确;点③处而在恰好反应,溶质只有醋酸钠,应该是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D不正确,答案选C。
点评:在判断酸碱中和过程中离子浓度变化以及离子浓度大小比较时,除了注意判断酸碱的用量外,最重要的是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒等,尤其是电荷守恒是经常用到的关系式,需要熟练掌握并能灵活运用。

练习册系列答案
相关题目
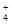 )与c(SO
)与c(SO )之比是 ( )
)之比是 ( )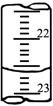
 甲
甲