题目内容
【题目】电解质溶液电导率越大导电能力越强。常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
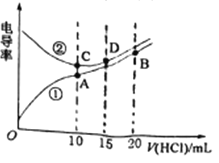
A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>B
B. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数Kb约为10-4
C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+]+2c[(CH3)2NH·H2O]
【答案】C
【解析】A、NaOH为强碱,二甲胺为弱碱,没有滴定时,NaOH溶液的电导率大于二甲胺的,曲线②代表滴定NaOH溶液的曲线,当加入10mL盐酸时,与NaOH、二甲胺恰好完全反应,A点溶质是强酸弱碱盐,C点溶质为NaCl,D点NaOH过量,B点过量HCl,强酸弱碱盐促进水的电离,NaCl对水的电离无影响,因为B点盐酸的量比D点NaOH量多,因此B点对水的抑制能力强于D点,因此相同温度下,水的电离程度为A>C>D>B,故A说法正确;B、在A点是二甲胺与盐酸恰好完全反应,(CH3)2NH2+的浓度约等于c(Cl-),(CH3)2NH的浓度约等于c(H+),因此Kh=10-6×10-6/0.01=10-10,Kb=Kw/Kh=10-4,故B说法正确;C、当在20mL时,c(Cl-)>c(H+)>c[(CH3)2NH2+]>c(OH-),故C说法错误;D、根据质子守恒,c(H+)=c(OH-)+ c[(CH3)2NH2+] +2c[(CH3)2NH·H2O],故D说法正确。

【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
【题目】由下列实验及现象得出的结论正确的是
实验 | 现象 | 结论 | |
A | SO2与H2S气体混合 | 产生淡黄色沉淀 | 氧化性:SO2>S |
B | 向盛有FeSO4溶液的试管中滴入氯水,然后滴入KSCN溶液 | 滴入KSCN后溶液变为红色 | 原FeSO4溶液已被空气中O2氧化变质 |
C | 试管中盛有Cu(NO3)2溶液,底部有少量铜,向其中加入稀硫酸 | 铜粉逐渐溶解 | 铜可与稀硫酸反应 |
D | 向2支盛有2mL相同浓度的NaOH溶液的试管中分别滴入2滴相同浓度的AlCl3和MgCl2溶液,振荡并静置 | 前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A. A B. B C. C D. D



