题目内容
19.根据元素周期表1~20号元素的性质和递变规律,回答下列问题.(1)非金属最强的元素是F,金属性最强的元素是K(填元素符号).
(2)属于稀有气体的有几种3.
(3)形成化合物种类最多的两种元素是C、H.(填元素符号或化学式,下同).
(4)第3周期中,原子半径最大的是(稀有气体除外)Na.
(5)推测Si、N最简单氢化物的稳定性:NH3大于SiH4.
分析 (1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强;
(2)1~20号元素中属于稀有气体的有He、Ne、Ar;
(3)C、H元素均形成有机物,二者形成化合物物质种类最多;
(4)同周期随原子序数增大,原子半径减小;
(5)非金属性越强,氢化物越稳定.
解答 解:(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,故1~20号元素中,非金属性最强为F,金属性最强的为K,故答案为:F;K;
(2)1~20号元素中属于稀有气体的有He、Ne、Ar,共有3种,故答案为:3;
(3)C、H元素均形成有机物,二者形成化合物物质种类最多,故答案为:C、H;
(4)同周期随原子序数增大,原子半径减小,故第三周期中Na原子半径最大,故答案为:Na;
(5)同周期自左而右非金属性增强、同主族自上而下非金属性增强,故非金属性N>Si,非金属性越强,氢化物越稳定,故氢化物稳定性:NH3>SiH4,故答案为:NH3>SiH4.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,有利于基础知识的巩固.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
9.甲苯分子被溴原子取代一个氢原子后,可能形成同分异构体数目是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
7.如图为元素周期表截取的短周期的一部分,即 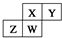 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
14.某一有机物A可发生如图变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有( )


| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
8.如果把Cu、Zn与稀H2SO4构成的原电池表示为Zn$\stackrel{H_{2}SO_{4}}{→}$Cu,则下列能表示原电池的是( )
| A. | Cu$\stackrel{H_{2}SO_{4}}{→}$Cu | B. | Cu$\stackrel{CuSO_{4}}{→}$Ag | C. | Zn$\stackrel{NH_{4}Cl}{→}$C | D. | Zn$\stackrel{C_{2}H_{5}OH}{→}$Cu |
 已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去).
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去). .
.