题目内容
(16分)纳米TiO2具有独特的光催化性、优异的颜色效应以及紫外线屏蔽等功能,在光催化剂、化妆品、抗紫外线吸收剂、功能陶瓷、气敏传感器件等方面具有广阔的应用前景。工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下:
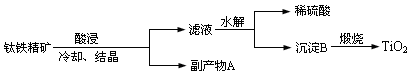
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式 ,酸浸时为了提高浸出率,可以采取的措施为 。
(2)钛铁精矿后冷却、结晶得到的副产物A为 ,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 。

(1)写出硫酸酸浸溶解钛铁精矿的离子方程式 ,酸浸时为了提高浸出率,可以采取的措施为 。
(2)钛铁精矿后冷却、结晶得到的副产物A为 ,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 。
⑴FeTiO3+6H+=Fe2++Ti4++3H2O(2分) 增大硫酸浓度或加热升高温度或边加硫酸边搅拦或增加浸出时间等(2分)
⑵FeSO4·7H2O(2分) 防止Ti(SO4)2水解、减少FeSO4·7H2O的溶解量(2分)
⑶促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀。(2分)
⑷水解得到的稀硫酸可以循环使用(2分)
⑸TiO2+2C+2Cl2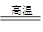 TiCl4+2CO(2分)、TiCl4+2Mg
TiCl4+2CO(2分)、TiCl4+2Mg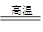 Ti+2MgCl2(2分)
Ti+2MgCl2(2分)
⑵FeSO4·7H2O(2分) 防止Ti(SO4)2水解、减少FeSO4·7H2O的溶解量(2分)
⑶促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀。(2分)
⑷水解得到的稀硫酸可以循环使用(2分)
⑸TiO2+2C+2Cl2
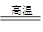 TiCl4+2CO(2分)、TiCl4+2Mg
TiCl4+2CO(2分)、TiCl4+2Mg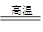 Ti+2MgCl2(2分)
Ti+2MgCl2(2分)⑴FeTiO3中Fe、Ti分别显+2、+4价,溶于硫酸得到对应的硫酸盐,因此方程式为FeTiO3+6H+=Fe2++Ti4++3H2O。要提高浸出率,则可以从影响反应速率的角度分析,即可通过增大硫酸浓度或加热升高温度或边加硫酸边搅拦或增加浸出时间等。
⑵根据(1)正的方程式可知,反应中有硫酸亚铁生成,结晶即得到FeSO4·7H2O,所以副产物A为硫酸亚铁溶液结晶得到的FeSO4·7H2O。结晶时不能加水,是为了防止Ti(SO4)2水解、减少FeSO4·7H2O的溶解量。
⑶稀释能增加水解程度,同时水解反应受吸热反应,升高温度增大水解程度。所以滤液水解时往往需加大量水稀释同时加热,主要是促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀。
⑷该工艺流程中硫酸可以循环使用,体现绿色化学理念。
(5)碳粉在高温下生成物应是CO,方程式为TiO2+2C+2Cl2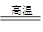 TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg
TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg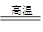 Ti+2MgCl2。
Ti+2MgCl2。
⑵根据(1)正的方程式可知,反应中有硫酸亚铁生成,结晶即得到FeSO4·7H2O,所以副产物A为硫酸亚铁溶液结晶得到的FeSO4·7H2O。结晶时不能加水,是为了防止Ti(SO4)2水解、减少FeSO4·7H2O的溶解量。
⑶稀释能增加水解程度,同时水解反应受吸热反应,升高温度增大水解程度。所以滤液水解时往往需加大量水稀释同时加热,主要是促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀。
⑷该工艺流程中硫酸可以循环使用,体现绿色化学理念。
(5)碳粉在高温下生成物应是CO,方程式为TiO2+2C+2Cl2
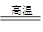 TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg
TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg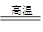 Ti+2MgCl2。
Ti+2MgCl2。
练习册系列答案
相关题目
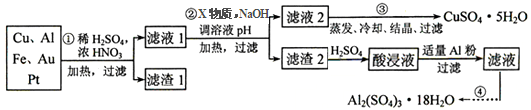
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。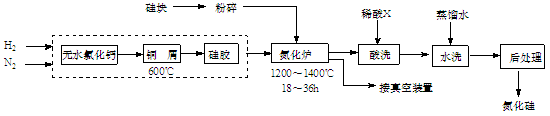
 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。