题目内容
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
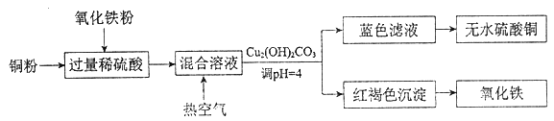
稀硫酸和氧化铁反应的离子方程式是_____________________________;铜和上述反应得到的物质反应的离子方程式是____________________________;向混合溶液中通入热空气的目的是_______________________________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
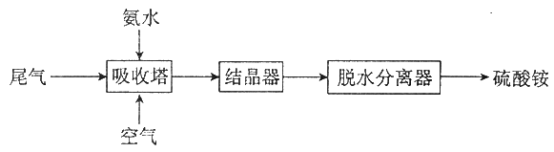
①吸收塔中发生的反应是氧化还原反应,反应中氧化剂和还原剂的物质的量之比是_________。
②检验硫酸铵中的NH4+的离子方程式是_________。
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 把Fe2+氧化成Fe3+ 过滤 1:2 NH4++OH-
CuSO4+SO2↑+2H2O Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 把Fe2+氧化成Fe3+ 过滤 1:2 NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【解析】(1)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②稀硫酸和氧化铁反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;铜和硫酸铁反应生成硫酸亚铁和硫酸铜,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;通入空气的作用是利用氧气把Fe2+氧化成Fe3+,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;通过过滤分离蓝色滤液和红褐色沉淀;(2)①吸收塔中氨气、二氧化硫和空气中的氧气反应生成硫酸铵,发生的反应方程式为:4NH3+2SO2+O2+2H2O =2(NH4)2SO4,反应中氧化剂为氧气,还原剂为二氧化硫,根据方程式可知,氧化剂与还原剂的物质的量之比是1:2;②检验硫酸铵中的NH4+是利用强碱并加热产物的气体能使湿润的红色石蕊试纸变蓝,反应的离子方程式是:NH4++OH-
CuSO4+SO2↑+2H2O;②稀硫酸和氧化铁反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;铜和硫酸铁反应生成硫酸亚铁和硫酸铜,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;通入空气的作用是利用氧气把Fe2+氧化成Fe3+,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;通过过滤分离蓝色滤液和红褐色沉淀;(2)①吸收塔中氨气、二氧化硫和空气中的氧气反应生成硫酸铵,发生的反应方程式为:4NH3+2SO2+O2+2H2O =2(NH4)2SO4,反应中氧化剂为氧气,还原剂为二氧化硫,根据方程式可知,氧化剂与还原剂的物质的量之比是1:2;②检验硫酸铵中的NH4+是利用强碱并加热产物的气体能使湿润的红色石蕊试纸变蓝,反应的离子方程式是:NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】下列各组物质中,满足下图物质一步转化关系的选项是
选项 | X | Y | Z |
A | Na | Na2O2 | Na2CO3 |
B | Cu | CuCl2 | Cu(OH)2 |
C | Al | Al2O3 | Al(OH)3 |
D | Fe | FeCl3 | FeCl2 |

A. A B. B C. C D. D
