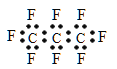
题目内容
【题目】将Na2O2投入FeCl2溶液中,可观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀
C.无气泡产生 D.无变化
【答案】B
【解析】
试题分析:将Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,2NaOH+FeCl2=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+H2O=4Fe(OH)3,4Fe(OH)2是白色沉淀易被氧化为红褐色的Fe(OH)3沉淀,所以看到的现象是:有大量气泡生成,出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,答案选B。

【题目】下表为元素周期表的一部分,参照元素A~I在表中的位置,用化学用语回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | B | C | D | |||||
3 | E | F | G | H | I | |||
4 | K | |||||||
(1)D、E、H形成的简单离子的半径由大到小的顺序是____________________。
(2)E2D2的电子式为:______________,GD2形成晶体的类型为:___________________。
(3)将一定量HD2通入足量C的最高价氧化物的水化物稀溶液中,反应的离子方程式是______________。
(4)设计实验探究I、K两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、CCl4。
请完成实验报告单:
实验内容 | 现象 |
步骤一:试管1:取少量氯水; 试管2:取少量NaBr溶液,滴加少量氯水。 | 试管2中的现象是:_________________ |
步骤二:分别向试管1、试管2中加少量 ______________(填试剂),振荡。 | 试管2中的现象是__________________ |
①试管1的作用是____________________。 试管2中反应的离子方程式为:___________,此实验的结论是_________________。 | |