题目内容
【题目】(1)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
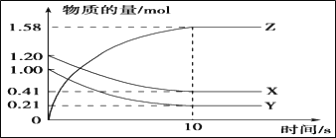
①反应开始到平衡,用Z表示的反应速率为_____________mol·L-1·s-1。
②Y的转化率为_________________。
③该反应的化学方程式为_____________________________________________。
(2)利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
①该原电池的正极反应式为:_________________________________。
②计算原稀硫酸的物质的量浓度为___________________。
③若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?_______(填“能”或“不能”) 若能组成原电池,此原电池的负极反应式是______________。
【答案】 0.079 79% X + Y ![]() 2Z 2H+ + 2e-=H2↑ 0.75mol/L 能 Zn - 2e-=Zn2+
2Z 2H+ + 2e-=H2↑ 0.75mol/L 能 Zn - 2e-=Zn2+
【解析】(1)①根据图像可知X和Y的物质的量减少,是反应物,Z的物质的量增加,是生成物,10s时反应达到平衡状态,消耗X是1.20mol-0.41mol=0.79mol,消耗Y是1.00mol-0.21mol=0.79mol,生成Z是1.58mol,根据变化量之比是相应的化学计量数之比可知该反应的化学方程式为X + Y![]() 2Z。反应开始到平衡,用Z表示的反应速率为
2Z。反应开始到平衡,用Z表示的反应速率为![]() =0.079mol·L-1·s-1。②Y的转化率为0.79mol/1.00mol×100%=79%。③根据以上分析可知该反应的化学方程式为X + Y
=0.079mol·L-1·s-1。②Y的转化率为0.79mol/1.00mol×100%=79%。③根据以上分析可知该反应的化学方程式为X + Y![]() 2Z。
2Z。
(2)①锌比铜活泼,锌是负极,铜是正极,溶液中氢离子放电,则该原电池的正极反应式为2H+ + 2e-=H2↑。②3.36L气体是氢气,物质的量是3.36L÷22.4L/mol=0.15mol,根据氢原子守恒可知硫酸的物质的量是0.15mol,所以原稀硫酸的物质的量浓度为0.15mol÷0.2L=0.75mol/L。③锌比铁活泼,若将铜棒换成铁片,仍按题给方式组合起来,仍然能够组成原电池,其中负极是仍然是锌,负极反应式是Zn-2e-=Zn2+。
电极:掌握原电池的工作原理是解答的关键,即原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,参照元素①~⑧在表中的位置,请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ||||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)画出⑤的离子结构示意图______。
(2)③、④、⑧的原子中半径最大的是_______(写编号)。
(3)④和⑥的最高价的氧化物的水化物中碱性强的是______。
②和⑦的气态氢化物中的稳定性强的是______(均填化学式)。
(4)写出一种由①②组成且含有非极性键的物质的电子式_________。