题目内容
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:
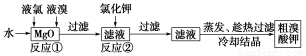
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
(1)6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2
(2)Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3
(3)①BrO3- ②KClO3、Br2 Br2 ③3∶1
【解析】分析实验过程,由于反应②中只加入KCl,不会发生氧化还原反应,反推知反应①中必生成BrO3-,由此得反应①中的化学方程式为6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2,第一次过滤掉的滤渣是MgO。经过反应②又过滤,那原因是什么呢?考虑到加入KCl发生的是复分解反应,反应发生的原因显然是利用MgCl2溶解度小的特点,反应的化学方程式为Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3,第二次过滤掉的滤渣是MgCl2,然后进行系列实验操作即可得KBrO3晶体。(3)在三个反应中BrO3-均作氧化剂,所以氧化性其最强。对比反应Ⅰ和Ⅱ,可知KBrO3过量时,Cl-被氧化成ClO3-,还原产物为Br2,反应Ⅲ中Br2既是氧化产物也是还原产物。③由题可知KBrO3的物质的量为4.8×10-3 mol,KCl的物质的量为6×10-3 mol,两者物质的量之比为4∶5。设参加反应Ⅰ的KBrO3的物质的量为x,则参加反应Ⅱ的KBrO3的物质的量为
(4-x),由Cl-守恒得:5x+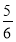 (4-x)=5,得x=
(4-x)=5,得x=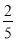 ,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。
,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案