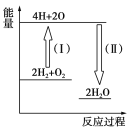
题目内容
【题目】已知:2X(g)+Y(g)a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: 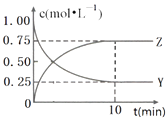
(1)a=;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为mol/(Lmin).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是(选填字母).
A.使用适当的催化剂
B.分离出Z
C.增大容器体积.
【答案】
(1)1;0.075
(2)10%
(3)B
【解析】解:(1)在体积为2L的密闭容器中充入6molX和2molY,X、Y的起始浓度分别为3mol/L、1mol/L,平衡时X、Y、Z浓度变化之比为△c(x):(1.00mol/L﹣0.25mol/l):0.75mol/L=2:1:1,故a=1,△c(x)=1.5mol/L,用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 ![]() =
= ![]() =0.075mol/L,
=0.075mol/L,
所以答案是:1;0.075mol/(Lmin);
(2.)平衡时n(X)=(3mol/L﹣1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数= ![]() =
= ![]() ×100%=10%,
×100%=10%,
所以答案是:10%;
(3.)反应2X(g)+Y(g)Z(g),提高Y的转化率,即使平衡正向移动,
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,Y转化率增大,故B正确;
C.增大容器体积,压强减小平衡逆向移动,Y转化率减小,故C错误;
所以答案是:B.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).