��Ŀ����
����Ŀ���������ѧ֪ʶ���ش��������⣺
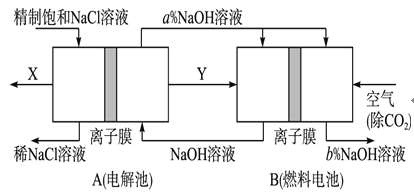
ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽������п��ϡ����ķ�Ӧ��ʵ�������A�ձ��ڵ���Һ�¶����ߣ�B�ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣
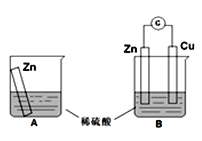
(1)B��Zn����_________���������ĵ缫��Ӧ��_________________��Cu���ϵ�������___________��
(2)������ת���ĽǶ������� A���ǽ���ѧ��ת��Ϊ_________��B����Ҫ�ǽ���ѧ��ת��Ϊ_________��
(3)��С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________��
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B���缫һ�����ܲμӷ�Ӧ
C��ԭ���װ���еĵ���������������·�������������������
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
(4)��B�У�����������1mol����ͨ��ʱ�������ϵ������仯��_________��
A��пƬ�ܽ�32.5g B��пƬ����32.5g
C��ͭƬ������2gH2 D��ͭƬ������1mol H2
���𰸡��� Zn-2e-�TZn2+ ����ɫ������� ���� ���� AD A
��������
(1)п-ͭ-ϡ����ԭ����У����ý���п��������пʧ���ӷ���������Ӧ��������������ͭ�ϵõ��ӷ�����ԭ��Ӧ��
(2)A�ձ����¶����ߣ��÷�Ӧ�Ƿ��ȷ�Ӧ��ԭ��ؽ���ѧ��ת���ɵ��ܣ�
(3)����ԭ���ԭ�������жϣ�
(4)п-ͭ-ϡ������ɵ�ԭ��ط�ӦΪZn+H2SO4=ZnSO4+H2 ��������ת�Ƶĵ��ӽ����ڷ���ʽ�������㡣
(1)п-ͭ-ϡ����ԭ����У����ý���п���������缫��ӦΪZn-2e-�TZn2+��������������ͭ�ϵõ��Ӳ�������������Cu���ϵ�����������ɫ����������ʴ�Ϊ������Zn-2e-�TZn2+������ɫ���������
(2)ʵ�������A�ձ����¶����ߣ�˵���÷�Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ����������������������������Ӧ�н���ѧ��ת�������ܣ�ԭ����ǽ���ѧ��ת���ɵ��ܣ��ʴ�Ϊ�����ܣ����ܣ�
(3)A��ԭ���Ҫ���Է����е�������ԭ��Ӧ������һ���е��ӵ�ת�ƣ���A��ȷ��B�����ý�����������������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��һ�㸺���ܽ⣬�����������ػ��������壬��B����C�����Ӳ���ͨ���������Һ����C����D����������������Ӧ������������ԭ��Ӧ��ԭ��ؽ�������Ӧ�ͻ�ԭ��Ӧ���Բ���������������D��ȷ���ʴ�Ϊ��AD��
(4)��ԭ��طŵ�ʱ��������пʧ���ӷ���������Ӧ�������������ӵõ��ӷ�����ԭ��Ӧ�����Ե�ط�ӦΪZn+H2SO4=ZnSO4+H2 ����
�赱��������1mol����ͨ��ʱ�������ϸ���пƬ�ܽ�x��ͭƬ����������y��
Zn+H2SO4=ZnSO4+H2 �� ת�Ƶ���
65g 1mol 2mol
x y 1mol
��![]() =
=![]() =
=![]() ����ã�x=32.5g��y=0.5mol��
����ã�x=32.5g��y=0.5mol��
��п�ܽ���32.5g�����������أ���A��ȷ��B����
ͭƬ��������0.5mol����������Ϊ1g����C��D����
��ѡA��