题目内容
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%

(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为Ni(s)+4CO(g)
 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示


则用SO2除去CO的热化学方程式为 _____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
(4)利用ClO2氧化氮氧化物反应过程如下:

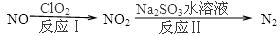
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。
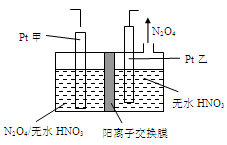
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 _____极,电解池中生成N2O5的电极反应式是________________。

(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)

 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:________| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |

 Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示

则用SO2除去CO的热化学方程式为 _____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。(4)利用ClO2氧化氮氧化物反应过程如下:

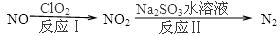
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 _____极,电解池中生成N2O5的电极反应式是________________。

(1)D (2分)
(2)SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-(2b-a)kJ·mol-1(2分)
(3)增大NH3浓度(或减小压强、降低温度)(2分)
(4)2 NO2+4SO32-=N2+4SO42-,(2分) 60(2分)
(5)阴(2分),N2O4+2HNO3-2e-=2N2O5+2H+(2分)
(2)SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-(2b-a)kJ·mol-1(2分)
(3)增大NH3浓度(或减小压强、降低温度)(2分)
(4)2 NO2+4SO32-=N2+4SO42-,(2分) 60(2分)
(5)阴(2分),N2O4+2HNO3-2e-=2N2O5+2H+(2分)
试题分析:(1)A、该反应是可逆反应,所以装有尾气净化装置的汽车排出的气体中仍然含有NO或CO,错误;B、570K时的平衡常数为1×1059,已经很高没必要提高温度,错误;C、增大压强平衡正向移动,理论上可增大净化效率,但不可取,净化装置一旦装上很难改变其压强,错误;D、该反应的平衡常数已经很高,但反应速率太慢,所以使用高效催化剂可大大提高反应速率,从而提高净化效率,正确,答案选D。
(2)由左图得出S(s)+O2(g)=SO2(g) △H="-a" kJ·mol-1 由图得出CO(g)+
 O2(g)= CO2(g) △H=-bkJ·mol-1,将两式结合得SO2除去CO的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-(2b-a)kJ·mol-1
O2(g)= CO2(g) △H=-bkJ·mol-1,将两式结合得SO2除去CO的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-(2b-a)kJ·mol-1(3)提高氮氧化物的转化率也即使平衡正向移动,可采取降温、减压、提高氨气的浓度等措施
(4)二氧化氮将亚硫酸钠氧化成硫酸钠本身被还原为氮气,离子方程式为2 NO2+4SO32-=N2+4SO42-,11.2L(标准状况)氮气的物质的量为0.5mol,则所需二氧化氮的物质的量为1mol,所以NO为2mol,其质量是60g
(5) Pt乙极由无水硝酸得到N2O4,发生还原反应,所以Pt乙为阴极,N2O4被氧化得N2O5所以电解池中生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+

练习册系列答案
相关题目


 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比 的变化关系。
的变化关系。 C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
 2Cl2+2H2O
2Cl2+2H2O

