题目内容
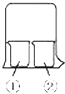
【题目】如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g) ![]() 2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
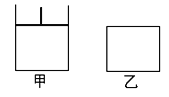
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
【答案】(1)A D(2分)(2)400 (2分)(3)>(2分)(4)2(2分);n(D)>0.6mol(2分)
【解析】
试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.反应有固体生成,所以随反应进行气体的质量减小,混合气体的总质量不随时间改变,说明到达平衡,A正确;B.不同物质表示正逆反应速率之比等于化学计量数之比,说明反应到达平衡.2v正(C)=3v逆(B),则v正(C):v逆(B)=3:2,不等于化学计量数之比2:3,B错误;C.开始向两容器中分别充入1molA、3molB,且A与B按1:3反应,无论是否到达平衡A、B的转化率自始至终都相等,C错误;D.随反应进行气体的质量减小,物质D质量增大,物质D的质量不随时间改变,说明到达平衡,D正确,答案选AD。
(2)甲体积可变,压强温度不变,则反应前后混合气体的总浓度相等(单位体积内含有的混合气体的物质的量相等)。开始加入1molA、3molB,体积为500ml,则开始混合气体的总浓度为(1mol+3mol)÷0.5L=8mol/L。平衡后C的浓度为2mol/L,则平衡时A、B的总的浓度为8mol/L-2mol/L=6mol/L,由于开始加入1molA、3molB,且A与B按1:3反应,所以平衡时A与B的浓度比为1:3,所以平衡时c(A)=1/4×6mol/L=1.5mol/L,c(B)=6mol/L-1.5mol/L=4.5mol/L。令平衡后的体积为VL,则平衡时n(A)=1.5Vmol,n(B)=4.5Vmol,n(C)=2Vmol,所以
A(g)+3B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
起始量(mol):1 3 0 0
转化量(mol):V 3V 2V V
平衡量(mol):1-V 3-3V 2V V
所以1-V=1.5V,解得V=0.4,即平衡后的体积为400ml。
(3)反应前后气体体积减小,甲比乙压强大,压强增大平衡向体积减小的方向移动,即向正反应移动,所以甲中B的转化率比乙中的大,即α乙(B)<α甲(B)。
(4)平衡时C的物质的量与(2)中平衡时C的物质的量相等,则为完全等效平衡,开始1molA、3molB按化学计量数转化到右边可得n(C)=2mol,所以n(C)=2mol。由(2)可知,平衡时C的物质的量为2Vmol=2×0.4mol=0.8mol,所以转化的C的物质的量为2mol-0.8mol=1.2mol,由方程式可知,需要D的物质的量为1/2×1.2mol=0.6mol,故n (D)>0.6mol。

【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 铜 | 氧化铜 | 稀硝酸 | 萃取 |
A. A B. B C. C D. D