题目内容
7.可逆反应在一定条件下达到化学平衡状态的标志是( )| A. | 反应停止了 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率相等 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答.
解答 解:A.化学反应为动态平衡,达到平衡状态时,正逆反应速率相等,但反应没有停止,故A错误;
B.达到平衡状态时,正逆反应速率相等,但不等于零,故B错误;
C.达到平衡状态时,反应物和生成物浓度关系不能确定,取决于起始物质的量浓度以及反应转化程度,不能作为判断是否达到平衡状态的依据,故C错误;
D.正反应速率等于逆反应速率,达到平衡状态,故D正确.
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,注意化学平衡状态的特征,达到平衡状态时正逆反应速率相等,但反应没有停止.

练习册系列答案
相关题目
18.下列不是海水淡化主要方法的是( )
| A. | 蒸馏法 | B. | 离子交换法 | C. | 电渗析法 | D. | 干馏法 |
15.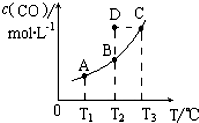 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
 在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:C(s)+H2O(g)?CO(g)+H2(g)的平衡物质的量浓度与温度 T的关系如图所示.下列说法错误的是( )| A. | 该反应的△H>0 | |
| B. | 若T1、T2 时的平衡常数分别为K1、K2,则K1=K2 | |
| C. | 通过加热可以使B 点变到C 点 | |
| D. | 在T2时若反应进行到状态D,则一定有υ(正)<υ(逆) |
2.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
12.已知常温下,0.1mol•L?1CH3COONH4溶液呈中性.下列有关叙述正确的是( )
| A. | 该溶液可由等体积、浓度均为0.1mol•L?1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加入纯水中,水的电离程度不变 | |
| C. | 常温下,电离常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO?)大于同浓度CH3COONa溶液中的c(CH3COO?) |
19.下表为六种短周期元素的部分性质:
下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
17.溴化碘(IBr)是一种卤素互化物,它的化学性质活泼,能与大多数金属反应,也能与某些分金属单质反应,并能与水发生如下反应:IBr+H2O→HBr+HIO,下列有关溴化碘的叙述不正确的是( )
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.