题目内容
【题目】研究铁及其化合物对于工业生产具有重要意义.
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是(用离子方程式表示).
(2)高铁酸钾(K2FeO4)是一种新型的水处理剂.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图1所示: 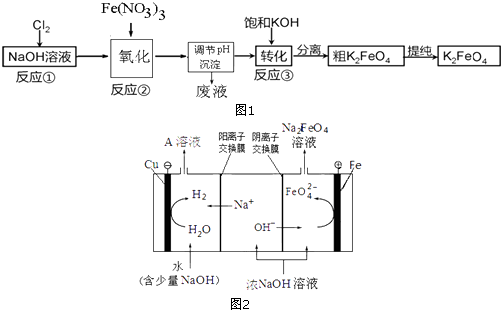
①反应②氧化过程所发生反应的离子方程式是: , 在生产中一般控制反应温度30℃以下,其原因是: .
②反应③中加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明 .
③在提纯K2FeO4中采用重结晶、过滤、洗涤、低温烘干的方法,洗涤滤渣的方法是 .
④若某温度下,将Cl2通入NaOH溶液中得到NaCl、NaClO、NaClO3的混合溶液,经测定溶液中ClO﹣与ClO3﹣的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 .
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示:阳极的电极反应式为;其中可循环使用的物质是 . (填化学式)
【答案】
(1)Fe3++3H2O?Fe(OH)3(胶体)+3H+
(2)2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;防止生成的高铁酸钠发生分解;该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次;11:3
(3)Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O;NaOH溶液
【解析】解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+ , 胶体表面积大,吸附能力强,达到净水目的, 所以答案是:Fe3++3H2OFe(OH)3(胶体)+3H+;(2)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
所以答案是:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;防止生成的高铁酸钠发生分解;②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
所以答案是:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次,
所以答案是:用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;④Cl2生成ClO﹣与ClO3﹣是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO﹣和ClO3﹣物质的量之比为1:2,
则可设ClO﹣为1mol,ClO3﹣为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1﹣0)+2mol×(5﹣0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为﹣1价,
则被还原的Cl的物质的量为: ![]() =11mol,
=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
所以答案是:11:3;(3)阳极是铁,故阳极上铁放电生成FeO42﹣ , 由于是碱性环境,故电极方程式为:Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e﹣=H2↑,c(OH﹣)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
所以答案是:Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O;NaOH溶液.

【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到因加入一滴盐酸后,溶液由黄色变为橙色,并为止.
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:所用盐酸溶液的体积为 mL.
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(D)酸式滴定管在滴定前有气泡,滴定后气泡消失
(4)某学生根据三次实验分别记录有关数据如表:请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:(NaOH)=(保留小数点后4位).
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |



