题目内容
【题目】按要求完成下列问题:
(1)甲基的电子式
(2)乙炔的结构式
(3)相对分子质量为72且沸点最低的烷烃的结构简式
(4)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
工业生产甲醇的常用方法是:CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJ/mol.
已知:2H2(g)+O2(g)=2H2O (l)△H=﹣571.6kJ/mol
H2(g)+ ![]() O2(g)=H2O(g)△H=﹣241.8kJ/mol
O2(g)=H2O(g)△H=﹣241.8kJ/mol
①H2的燃烧热为kJ/mol.
②CH3OH(g)+O2(g)CO(g)+2H2O(g)的反应热△H= .
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)CH3OH(g),则可用来判断该反应达到平衡状态的标志有 . (填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(5)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1
能使化学反应速率加快的措施有(填序号).
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
【答案】
(1)
(2)H﹣C≡C﹣H
(3)C(CH3)4
(4)285.8;﹣392.8 kJ/mol;AD
(5)②④
【解析】解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: 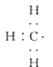 ,所以答案是:
,所以答案是: 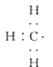 ;
;
(2.)乙炔分子中含有一个C≡C,乙炔的结构式H﹣C≡C﹣H;所以答案是:H﹣C≡C﹣H;(3.)设烷烃的分子式为CxH(2x+2) ,
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12 ,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3 ,
主链有4个碳原子的:CH3CH(CH3)CH2CH3 ,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故C(CH3)4 ,
所以答案是:C(CH3)4;
(4.)①2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1①
H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1②,
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1②,
根据盖斯定律①× ![]() +②可得:氢气的燃烧热的热化学方程式为:
+②可得:氢气的燃烧热的热化学方程式为:
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol,
O2(g)=H2O(l)△H=﹣285.8kJ/mol,
所以氢气的燃烧热为:△H═﹣285.8KJ/mol,
所以答案是:285.8;
②CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJ/mol②,
H2(g)+ ![]() O2(g)=H2O(g)△H=﹣241.8kJ/mol②,
O2(g)=H2O(g)△H=﹣241.8kJ/mol②,
根据盖斯定律②×2﹣①得到:CH3OH(g)+O2(g)CO(g)+2H2O(g)△H=﹣392.8 kJ/mol,
所以答案是:﹣392.8 kJ/mol;
③A.CO百分含量保持不变,说明CO的浓度保持不变,说明处于平衡状态,故A正确;
B.容器中H2浓度与CO浓度相等,并不能代表物质的量不再发生变化,因此不能作为平衡的标志,故B错误;
C.容器的体积不变,气体的质量守恒,所以密度始终不变,因此不能作为平衡的标志,故C错误,
D.CO的生成速率为逆速率,CH3OH的生成速率为正速率,二者相等,说明正逆反应速率相等,说明处于平衡状态,故D正确,
故选AD;
(5.)①增加C的物质的量,C为固体,其浓度不变,所以反应速率不变,故错误;
②升高反应温度,反应速率增大,故正确;
③随时吸收CO、H2转化为CH3OH,反应物的浓度减小,则反应速率减小,故错误;
④密闭定容容器中充入CO(g),CO的浓度增大,则反应速率增大,故正确;
所以答案是:②④.
【考点精析】通过灵活运用反应热和焓变和化学平衡状态的判断,掌握在化学反应中放出或吸收的热量,通常叫反应热;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等即可以解答此题.

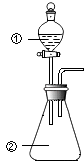
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测中的现象 |
A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D