题目内容
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( )
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
B
【解析】依题写出热化学方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,②H2(g)+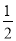 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,根据盖斯定律①-②×2-③得:CH4(g)=C(s)+2H2(g) ΔH=+74.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,根据盖斯定律①-②×2-③得:CH4(g)=C(s)+2H2(g) ΔH=+74.8 kJ·mol-1

练习册系列答案
相关题目