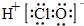题目内容
9.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )| A. | 放电时,溶液中的OH-向负极移动 | |
| B. | 放电时,正极附近溶液的碱性增强 | |
| C. | 放电时,每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 充电时,阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |
分析 A.放电时,原电池原理阴离子向负极移动;
B.根据放电时正极反应为FeO42-+3e-+4H2O=Fe(OH)3+5OH-判断;
C.放电时正极反应为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,1mol K2FeO4被还原要得到3mol电子;
D.充电时阳极阳极发生Fe(OH)3失电子的氧化反应.
解答 解:A.放电时,原电池原理阴离子向负极移动,所以OH-向负极移动,故A正确;
B.放电时正极反应为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则附近有OH-生成,所以正极附近碱性增强,故B正确;
C.放电时正极反应为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,所以每转移3 mol电子,正极有1 mol K2FeO4被还原,故C错误;
D.充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故D正确;
故选C.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
20.下列离子方程式书写不正确的是( )
| A. | 硫酸铜溶液和氢氧化钠溶液反应:Cu2-+2OH-═Cu(OH)2↓ | |
| B. | 盐酸和氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 碳酸钙和盐酸溶液:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡和硫酸的反应:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ |
17.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | SO2和HClO都具有漂白作用,且漂白的化学原理相同 |
14.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化包含化学反应的是( )
| A. | NaCl晶体溶于水 | B. | 氯原子结合成氯分子 | ||
| C. | 臭氧转化为氧气 | D. | 干冰气化 |
1.苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯. 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.其制备方法为:

已知:
*苯甲酸在100℃会迅速升华.
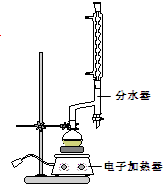 实验步骤如下:
实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸,25mL 95%的乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是(填入正确选项前的字母)C.
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤③中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为90.02%.

已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
 实验步骤如下:
实验步骤如下:①在圆底烧瓶中加入12.20g苯甲酸,25mL 95%的乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,控制温度在65~70℃加热回流2h.利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性.用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分.
④检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是(填入正确选项前的字母)C.
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤③中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为90.02%.
18.下列操作中错误的是( )
| A. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 除去CO2中的少量SO2;通过盛有饱和NaHCO3溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
19.已知,室温下存在反应3HNO2═HNO3+2NO↑+H2O;在酸性溶液中,NO 可将 MnO还原为Mn2+且无气体生成;酸性KMnO4溶液可吸收氮的氧化物.某化学兴趣小组设计了如下探究实验(实验前先排尽装置中的空气):
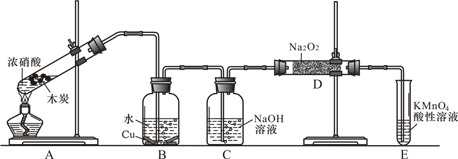
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)B瓶中可以观察到的现象是产生无色气体,溶液逐渐变蓝,C瓶出来的气体是NO.
(3)实验时观察到D 管内固体颜色逐渐变为白色.据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
(4)E装置的作用是吸收D中未反应完的NO,以免污染空气.
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管).

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)B瓶中可以观察到的现象是产生无色气体,溶液逐渐变蓝,C瓶出来的气体是NO.
(3)实验时观察到D 管内固体颜色逐渐变为白色.据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
| 实验操作 | 实验现象 | 实验结论 |
| D管生成的是NaNO2 |
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管).