题目内容
14.下列指定反应的离子方程式正确的是( )| A. | 氨水吸收少量的CO2气体:NH3•H2O+CO2═NH4++HCO3- | |
| B. | Na2SO3溶液中SO32-的水解:SO32-+2H2O═H2SO3+2OH- | |
| C. | KClO3溶液与浓盐酸反应:ClO3-+5Cl-+6H+═3Cl2↑+3H2O | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH反应:Fe2++2OH-═Fe(OH)2↓ |
分析 A.反应生成碳酸铵;
B.水解分步进行,以第一步为主;
C.发生氧化还原反应生成氯气、KCl和水;
D.漏写铵根离子与碱的反应.
解答 解:A.氨水吸收少量的CO2气体的离子反应为2NH3•H2O+CO2═2NH4++CO32-+H2O,故A错误;
B.Na2SO3溶液中SO32-的水解离子反应为SO32-+H2O?HSO3-+OH-,故B错误;
C.KClO3溶液与浓盐酸反应的离子反应为ClO3-+5Cl-+6H+═3Cl2↑+3H2O,故C正确;
D.(NH4)2Fe(SO4)2溶液与过量NaOH反应的离子反应为2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
4.下列变化必须加入还原剂的是( )
| A. | HCO3-→CO2 | B. | KClO3→KCl | C. | FeO→Fe3O4 | D. | MnO4-→Mn2+ |
5.镁、铁、锌三种金属单质中的两种组成的混合物共12g,与足量的稀盐酸反应,产生标准状况下的氢气5.6L,由此可判断混合物中必定含有( )
| A. | Mg | B. | Fe | C. | Zn | D. | 无法判断 |
2.能正确表示下列反应的离子方程式( )
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 金属铝溶于氢氧化钠溶液:2Al+2OH-+2H2O2[Al(OH)4]-+3H2↑ |
9.下列有关氧元素及其化合物的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: | |
| C. | 水分子的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
19.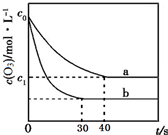 臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
 臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )| A. | 反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△S<0 | |
| B. | 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb | |
| C. | 曲线b对应的条件改变可能是密闭容器的体积变为4.0 L | |
| D. | 若c1=0.3mol•L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol•L-1•s-1 |
 高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等).
高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等).