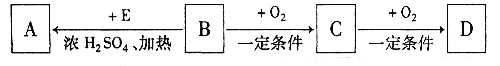
题目内容
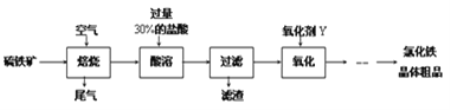
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
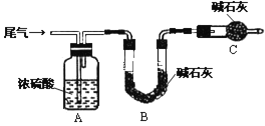
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
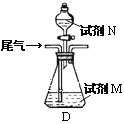
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
【答案】增大反应物的接触面积,加快反应速率 提高铁元素的浸出率 抑制Fe3+水解 球形干燥管 防止空气中的水蒸气、CO2进入B装置 该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,导致所测SO2气体的体积分数偏大 SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+ 1.00% 3SO2+3Ba2++2NO3-+2H2O = 3BaSO4↓+2NO+4H+
【解析】
(1)需将硫铁矿粉碎再焙烧的目的是矿石颗粒越小,与空气的接触面积越大,燃烧越充分。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是酸溶时可使反应充分,提高铁元素的浸出率;氧化时盐酸过量,可抑制Fe3+的水解。
(3)①C仪器的名称是球形干燥管,装置C的作用是防止空气中的水蒸气、CO2进入B装置,影响SO2含量的测定。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,该方案不合理,因为尾气中的CO2也能被碱石灰吸收。
③若试剂M、N分别是碘水、BaCl2溶液,D中发生的反应为SO2+I2+2H2O+BaCl2=BaSO4↓+2HI+2HCl,尾气中SO2的体积分数为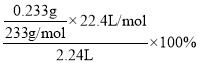 。
。
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色,则瓶内生成的气体为NO,SO2和Ba(NO3)2溶液反应的化学方程式为3SO2+3Ba(NO3)2+2H2O = 3BaSO4↓+2NO+4HNO3。
(1)需将硫铁矿粉碎再焙烧的目的是矿石颗粒越小,与空气的接触面积越大,燃烧越充分。答案为:增大反应物的接触面积,加快反应速率;
(2)酸溶及后续过程中均需保持盐酸过量,其目的是酸溶时可使反应充分,提高铁元素的浸出率;氧化时盐酸过量,可抑制Fe3+的水解。答案为:提高铁元素的浸出率;抑制Fe3+水解;
(3)①C仪器的名称是球形干燥管,装置C的作用是防止空气中的水蒸气、CO2进入B装置,影响SO2含量的测定。答案为:球形干燥管;防止空气中的水蒸气、CO2进入B装置;
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,该方案不合理,因为尾气中的CO2也能被碱石灰吸收,导致所测SO2气体的体积分数偏大。答案为:该方案不合理,因为尾气中的CO2也能被B装置中的碱石灰吸收,导致所测SO2气体的体积分数偏大;
③若试剂M、N分别是碘水、BaCl2溶液,D中发生的反应为SO2+I2+2H2O+BaCl2=BaSO4↓+2HI+2HCl,反应的离子方程式为SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;尾气中SO2的体积分数为 。答案为:SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;1.00%;
。答案为:SO2+I2+2H2O+ Ba2+=BaSO4↓+2I-+4H+;1.00%;
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色,则瓶内生成的气体为NO,SO2和Ba(NO3)2溶液反应的化学方程式为3SO2+3Ba(NO3)2+2H2O = 3BaSO4↓+2NO+4HNO3。答案为:3SO2+3Ba2++2NO3-+2H2O = 3BaSO4↓+2NO+4H+。

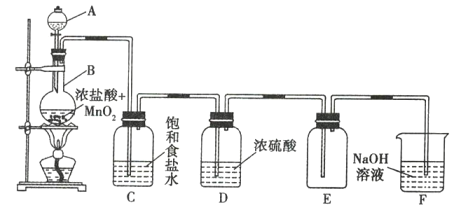
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
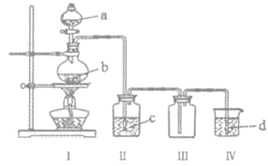
Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D