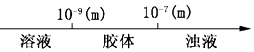题目内容
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:请回答下列问题: 
(1)白色沉淀B中金属元素的离子结构示意图为 , A的电子式为 .
(2)步骤3中生成沉淀C的离子方程式为 .
(3)X的化学式为 , 该抗酸药不适合胃溃疡重症患者使用,原因是 .
(4)设计实验方案验证步骤3后得到的无色溶液中的含碳离子 .
【答案】
(1)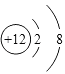 ;
;![]()
(2)AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
(3)AlMg3(CO3)(OH)7;和胃酸反应生成二氧化碳容易造成胃穿孔
(4)取少量容易少许于试管中,加入氯化钙无现象,在加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子
【解析】解:抗酸药X加入过量盐酸生成无色气体A和无色溶液A,溶液A中加入过量氢氧化钠溶液过滤得到白色沉淀B和溶液B,溶液B中加入足量A得到白色沉淀C,沉淀C加入过量氢氧化钠溶液完全溶解,说明沉沉的C为Al(OH)3 , 则溶液B含有偏铝酸钠,A为CO2,无色溶液C为碳酸氢钠溶液,抗酸药X仅含五种短周期元素,判断沉淀B只能为Mg(OH)2 , 无色溶液A为AlCl3溶液和MgCl2溶液,抗酸药X加入过量盐酸生成无色气体二氧化碳,说明含有CO32﹣ , Al3+ , Mg2+ , 其中n(Al3+)=n(Al(OH)3)= ![]() =0.01mol,n(Mg2+)=n(Mg(OH)2)=
=0.01mol,n(Mg2+)=n(Mg(OH)2)= ![]() =0..03mol,n(CO32﹣)=n(CO2)=
=0..03mol,n(CO32﹣)=n(CO2)= ![]() =0.01mol,则得到剩余部分质量=2.78g﹣0.01mol×27g/mol﹣0.03mol×24g/mol﹣0.01mol×60g/mol=1.19g,依据电荷守恒,物质中含有7个负电荷,则一个的质量=
=0.01mol,则得到剩余部分质量=2.78g﹣0.01mol×27g/mol﹣0.03mol×24g/mol﹣0.01mol×60g/mol=1.19g,依据电荷守恒,物质中含有7个负电荷,则一个的质量= ![]() =0.17g,n(OH﹣)=
=0.17g,n(OH﹣)= ![]() =0.07mol,判断为OH﹣ , 得到化学式为AlMg3(CO3)(OH)7 , (1)上述分析可知白色沉淀B中金属元素为镁元素,镁离子核内有12个质子,核外有两个电子层,第一层2个电子,第二层8个电子,镁离子结构示意图为
=0.07mol,判断为OH﹣ , 得到化学式为AlMg3(CO3)(OH)7 , (1)上述分析可知白色沉淀B中金属元素为镁元素,镁离子核内有12个质子,核外有两个电子层,第一层2个电子,第二层8个电子,镁离子结构示意图为 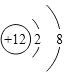 ,A为二氧化碳属于共价化合物,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为
,A为二氧化碳属于共价化合物,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ![]() ,所以答案是:
,所以答案是: 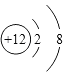 ;
; ![]() ;(2)步骤3中生成沉淀C为Al(OH)3 , 反应的离子方程式为AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;(3)上述分析计算可知X为AlMg3(CO3)(OH)7 , X和胃酸反应生成二氧化碳容易造成胃穿孔,引起危险,所以答案是:AlMg3(CO3)(OH)7;和胃酸反应生成二氧化碳容易造成胃穿孔;(4)设计实验方案验证溶液C中的含碳离子为HCO3﹣ , 取少量容易少许于试管中,加入氯化钙无现象,在加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子,所以答案是:取少量容易少许于试管中,加入氯化钙无现象,在加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子.
;(2)步骤3中生成沉淀C为Al(OH)3 , 反应的离子方程式为AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;(3)上述分析计算可知X为AlMg3(CO3)(OH)7 , X和胃酸反应生成二氧化碳容易造成胃穿孔,引起危险,所以答案是:AlMg3(CO3)(OH)7;和胃酸反应生成二氧化碳容易造成胃穿孔;(4)设计实验方案验证溶液C中的含碳离子为HCO3﹣ , 取少量容易少许于试管中,加入氯化钙无现象,在加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子,所以答案是:取少量容易少许于试管中,加入氯化钙无现象,在加入盐酸生成无色无味的气体,通入澄清石灰水变浑浊,证明含有碳酸氢根离子.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】NH3及其盐都是重要的化工原料. 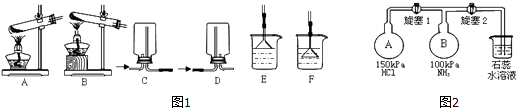
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为;该反应发生、气体收集和尾气处理装置如图1依次为;
(2)按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是 , 稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是;
(3)写出NH4Cl溶液水解的离子方程式;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | … | |
1 | 250 | X | … | ||
2 | 250 | … |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为(只列出算式,忽略水自身电离的影响).