题目内容
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
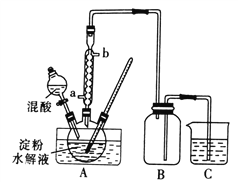
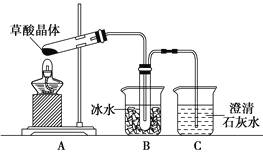
(I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
(II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。

(1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。
(2)请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中;
步骤2:调节水样的pH为7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL;
步骤5:______________;
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。
(3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。
【答案】 冷凝管 b 酚酞 当滴入最后一滴烧碱溶液时,溶液变红且半分钟不褪色 0.24 盐酸的挥发 用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响 ClO![]() +4H++4I-=Cl-+2I2+2H2O 调节溶液的pH≤2.0
+4H++4I-=Cl-+2I2+2H2O 调节溶液的pH≤2.0 ![]()
【解析】本题主要考查滴定法的应用。
(I)(1)仪器A的名称是冷凝管,水的流向是“下进上出”,水通入A的进口为b。
(2)若滴定终点时溶液的pH=8.8,溶液呈碱性,则选择的指示剂为酚酞。滴定终点现象为当滴入最后一滴烧碱溶液时,溶液变红且半分钟不褪色。
(3) SO2~H2SO4~2NaOH,该葡萄酒中SO2含量为:0.0900mol·L-1×25.00 mL/2×64g/mol/300mL=0.24g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是盐酸的挥发,在不改变装置的情况下,如何改进:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
(II)(1)pH≤2.0时ClO被I-还原为Cl-,ClO与I-反应的离子方程式:ClO![]() +4H++4I-=Cl-+2I2+2H2O。
+4H++4I-=Cl-+2I2+2H2O。
(2)步骤5:调节溶液的pH≤2.0;
(3) ClO2~I-~Na2S2O3,ClO~I-~4Na2S2O3,该饮用水中ClO的物质的量为(cV2/4-cV1)mol,浓度为![]() mol·L-1。
mol·L-1。

【题目】在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O,摩尔质量为183g/mol),受热过程中不同温度范国内分别得到一种固体物质,其质量如下表:
温度范围℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,210℃~290℃过程中产生的气体只有CO2,则290℃~320℃温度范围内的固体物质是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5