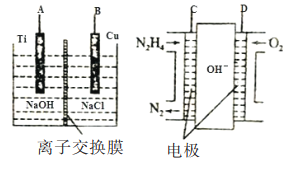
��Ŀ����
����Ŀ��������������д��ȷ����
A. 2H2��g��+O2��g��=2H2O��g����H=-483��6kJ��mol��1����1mol������ȼ���ȴ���241.8 kJ��mol��1
B. H2��g��+F2��g��=2HF��g����H=-270kJ��mol��1������ͬ�����£�2molHF�������������1mol������1mol ����������֮��
C. ��20��0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28��7kJ�����������ʾ���кͷ�Ӧ���Ȼ�ѧ����ʽΪNaOH+HCl=NaCl+H2O��H=-57��4kJ��mol��1
D. 500�桢30MPaʱ��������ӦN2��g��+3H2��g��![]() 2NH3��g�� ��H=-38��6kJ��mol��1���ڴ������½�1��5molH2����N2��ַ�Ӧ���ų�����19��3kJ
2NH3��g�� ��H=-38��6kJ��mol��1���ڴ������½�1��5molH2����N2��ַ�Ӧ���ų�����19��3kJ
���𰸡�A
��������
A��ˮ��������Һ��Ҫ�ų�������
B����Ӧ�������ɷ�Ӧ�����������������Ĵ�С��ϵ������
C���Ȼ�ѧ����ʽҪ�������ʵ�״̬��
D��N2��g��+3H2��g��![]() 2NH3��g���ǿ��淴Ӧ����Ӧ�ﲻ��ȫ����Ӧ��
2NH3��g���ǿ��淴Ӧ����Ӧ�ﲻ��ȫ����Ӧ��
A�� 2H2��g��+O2��g��=2H2O��g����H=-483��6kJ��mol��1��ˮ��������Һ��Ҫ�ų���������1mol������ȼ���ȴ���241.8 kJ��mol��1����A��ȷ��
B�����Ȼ�ѧ����ʽH2��g��+F2��g��=2HF��g����H=-270 kJ��mol��1��֪����Ӧ���ȣ���1 mol������1 mol����������������2 mol�����������������B����
C���Ȼ�ѧ����ʽû�б������ʵ�״̬����C����
D��H2�����ʵ���Ϊ1.5mol����ȫ����1.5mol������ų�19.3kJ���������ڸ÷�ӦΪ���淴Ӧ��������������ȫת���ɰ��������Էų�������С��19.3kJ����D����
��ѡA��

 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д�����Ŀ��һ�������½��з�Ӧ��COCl2(g) ![]() Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵������ȷ����( )
A. ����Cl2��ƽ����Ӧ���ʣ�0��2s��2��4s��B. 0��2s COCl2��ƽ���ֽ�����Ϊ0.15mol��L��1��s��1
C. 6sʱ����Ӧ�ﵽ�����D. �������£�COCl2�����ת����Ϊ40%
����Ŀ��25��ʱ��5�����ε��ܶȻ�����(Ksp)�ֱ���:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8��10-10 | 1.4��10-5 | 6.3��10-50 | 7.7��10-13 | 8.51��10-16 |
����˵������ȷ����
A. �Ȼ������廯���͵⻯�����ܽ�����μ�С
B. ���������ܽ���ˮ�������м����������ƹ��壬�ܵõ���ɫ����
C. ��5mL1.5��10-5mol/L��NaCl��Һ�У�����1��(1mLԼ20��)1.0��10-3mol/L��AgNO3��Һ�����ܹ۲쵽��ɫ����
D. ���ձ��з���6.24g���������壬��200gˮ��������ܽ�����ñ�����Һ�����Ϊ200mL,��Һ��Ag+�����ʵ���Ũ��Ϊ0.2mol/L��