题目内容
8.A、B、C、D、E五种常见单质,已知A、B、C、D在常温下均为气态.其中D能分别跟A、B、C两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合,有关的转化关系如图所示(反应条件均已略去).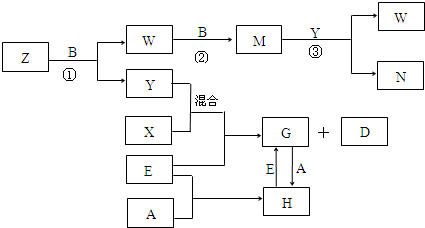
回答下列问题:
(1)A的化学式为Cl2,
(2)写出反应③的化学反应方程式3NO2+H2O=NO+2HNO3;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为0.5NA,则参加反应的E的质量为14g;
(5)将Z与N反应后的产物溶于水中,则溶液的pH(填“<”或“>”)<7,其原因是在溶液中NH4NO3电离出的NH4+发生水解:NH4++H2O?NH3•H2O+H+使溶液呈酸性,故溶液的pH<7.
分析 A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,应分别为H2、N2、O2、Cl2中的一种,其中D能分别跟A、B、C在一定条件下两两化合,则D为H2,生成化合物X、Y、Z分别为NH3、H2O、HCl中的一种,A与B、C均不能直接化合,可推知A为Cl2,故X为HCl,由转化关系中,Z与B反应得到W与Y,可推知B为O2,故C为N2,Y为H2O,Z为NH3,W为NO,NO与氧气反应得到M为NO2,M与Y(H2O)反应得到W与N,则N为HNO3.E与HCl、H2O反应得到G与D(H2),则E为活泼金属单质,由G?H的相互转化可知E为变价金属,可推知E为Fe,故G为FeCl2,H为FeCl3,据此解答.
解答 解:A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,应分别为H2、N2、O2、Cl2中的一种,其中D能分别跟A、B、C在一定条件下两两化合,则D为H2,生成化合物X、Y、Z分别为NH3、H2O、HCl中的一种,A与B、C均不能直接化合,可推知A为Cl2,故X为HCl,由转化关系中,Z与B反应得到W与Y,可推知B为O2,故C为N2,Y为H2O,Z为NH3,W为NO,NO与氧气反应得到M为NO2,M与Y(H2O)反应得到W与N,则N为HNO3,E与HCl、H2O反应得到G与D(H2),则E为活泼金属单质,由G?H的相互转化可知E为变价金属,可推知E为Fe,故G为FeCl2,H为FeCl3,
(1)由上述分析可知,A为Cl2,故答案为:Cl2;
(2)反应③的化学方程式为:3NO2+H2O=NO+2HNO3,故答案为:3NO2+H2O=NO+2HNO3;
(3)NH3和NO在催化剂作用下反应生成N2和H2O,这是一个很有实际意义的反应,可以消除NO对环境的污染,该反应的化学方程式为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O,
故答案为:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O;
(4)将过量的Fe加到HNO3的稀溶液中,反应生成硝酸亚铁,若过程中转移电子的数目为0.5NA,电子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=0.5mol,则参加反应的Fe的物质的量=$\frac{0.5mol}{2}$=0.25mol,参加反应的E的质量=0.25mol×56g/mol=14g,
故答案为:14;
(5)Z为NH3,N为HNO3,Z与N反应后的产物溶于水中得NH4NO3溶液,在溶液中NH4NO3电离出的NH4+发生水解:NH4++H2O?NH3•H2O+H+ 使溶液呈酸性,故溶液的pH<7,
故答案为:<;在溶液中NH4NO3电离出的NH4+发生水解:NH4++H2O?NH3•H2O+H+ 使溶液呈酸性,故溶液的pH<7.
点评 本题考查无机物推断,“A、B、C、D在常温下均为气态”是推断突破口,再结合题目信息与转化关系进行推断,对学生的逻辑推理有一定的要求,熟练掌握元素化合物性质是关键,难度中等.

已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol.
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol.
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol | |
| C. | N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol | |
| D. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
| A. | 在标准状况下,1mol 任何物质的体积约为22.4L | |
| B. | 22.4L氮气的物质的量一定是1mol | |
| C. | 在标准状况下0.5mol 氢气和氧气的混合气体的总体积约为11.2L | |
| D. | 如果1mol气体的体积为22.4L,则这些气体一定处于标准状况 |
| A. | 氢氧化铁胶体中的铁离子和氯离子可用渗析法除去 | |
| B. | 氯化钠中有少量氯化铵,加过量的烧碱溶液后加热蒸干 | |
| C. | 乙酸乙酯中混有少量乙酸,用饱和碳酸钠溶液洗涤后分液 | |
| D. | 硬脂酸甘油酯中混有少量的甘油,用盐析法除去 |
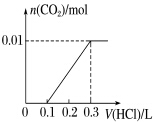
| A. | 12 | B. | 11 | C. | 7 | D. | 3 |
| A. | XO3-中X为+5价,故X元素位于第VA族 | |
| B. | X位于第二周期第VIIA族 | |
| C. | X可能是氯元素 | |
| D. | X可能是氮元素 |
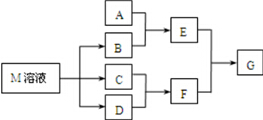 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):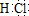 .
.
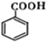 、
、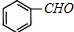 ;
; 、
、 .
.