题目内容
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。下图路线中的①-③、Ⅰ-Ⅲ分别是工业生产硝酸和雷电高能固氮过程中硝酸的生成途径。回答下列问题: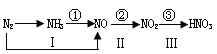
(1)雷电高能固氮生产硝酸的三个反应中,是否均为氧化还原反应?_______。
(2)图中途径I、①和②对应的三个反应中,常温下就能进行的是途径________。
(3)途径③对应的反应为NO2+H2O—HNO3+NO(未配平),该反应过程中氧化产物和还原产物的物质的量之比为__________________。
(4)硝酸必须保存于棕色瓶里并置于阴凉处的原因是____________________;可用铝质或铁质容器盛放冷的浓硝酸的原因是_____________________。
(5)硝酸的用途之一是与氨气反应制硝酸铵,其化学方程式为_____________。
【答案】 是 ② 2:1 硝酸光照、受热易分解 浓硝酸使铁、铝钝化 HNO3+NH3=NH4NO3
【解析】(1)在反应过程中有元素化合价变化的化学反应叫做氧化还原反应;在氧化还原反应中,所含元素的化合价降低的反应物,叫做氧化剂;所含元素的化合价升高的反应叫做还原剂。所以雷电高能固氮生产硝酸的三个反应中,均为氧化还原反应。
(2)一氧化氮常温下与氧气反应生成二氧化氮。
(3)3NO2+H2O=2HNO3+NO反应中,硝酸为氧化产物,一氧化氮为还原产物。
(4)硝酸具有不稳定性,见光受热易分解;常温下,铁铝遇浓硝酸发生钝化。
(5)硝酸与氨气反生成硝酸铵。
(1)在反应过程中有元素化合价变化的化学反应叫做氧化还原反应;在氧化还原反应中,所含元素的化合价降低的反应物,叫做氧化剂;所含元素的化合价升高的反应叫做还原剂。所以雷电高能固氮生产硝酸的三个反应中,①I![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),②II.
),②II.![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),③III.
),③III.![]() (氧化剂:
(氧化剂:![]() ,还原剂:
,还原剂:![]() ),通过以上分析可知,均为氧化还原反应;正确答案:是。
),通过以上分析可知,均为氧化还原反应;正确答案:是。
(2)氮气和氧气放电反应,氨气和氧气加热条件下发生催化氧化,一氧化氮常温下与氧气反应,因此常温下就能进行的是途径②;正确答案:②。
(3)根据电子守恒和质量守恒,配平该反应:3NO2+H2O=2HNO3+NO,NO2中+4价氮元素升高到HNO3中+5价氮元素,发生氧化反应,氧化产物有2mol,NO2中+4价氮元素降低到NO中+2价氮元素,发生还原反应,还原产物有1 mol,因此该反应过程中氧化产物和还原产物的物质的量之比为2:1 ;正确答案:2:1。
4)硝酸具有不稳定性,见光受热易分解,因此硝酸必须保存于棕色瓶里并置于阴凉处;常温下,浓硝酸能够使铁或铝发生钝化,因此可用铝质或铁质容器盛放冷的浓硝酸;正确答案:硝酸光照、受热易分解;浓硝酸使铁、铝钝化。
(5)硝酸与氨气反生成硝酸铵,化学方程式为:HNO3+NH3=NH4NO3;正确答案:HNO3+NH3=NH4NO3。