题目内容
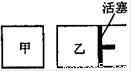
初始时温度、体积均相同的容器中N2 (g)+3H2 (g)?2NH3 (g),有下列两种不同充料在恒温(T)、恒压(P)下分别建立平衡.下列有关叙述不正确的是:( )Ⅰ.N2、H2的起始物质的量分别为1mol和3mol;
Ⅱ.NH3的起始物质的量为4mol.
A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同
B.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1:2
C.途径Ⅰ和途径Ⅱ化学平衡常数数值相同
D.平衡时:途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1:2
【答案】分析:途径Ⅰ.N2、H2的起始物质的量分别为1mol和3mol;途径Ⅱ.NH3的起始物质的量为4mol,按化学计量数转化到左边,可得2molN2、6molH2,氮气与氢气的物质的量之比为1:3,与途径Ⅰ相同,恒温恒压下,途径Ⅱ与途径Ⅰ为等效平衡,同种物质的浓度相同、百分含量相同,相同反应物的转化率相同,但相同物质的物质的量途径Ⅱ是途径Ⅰ的2倍.平衡常数只受温度影响,温度相同,平衡常数相同,据此结合选项解答.
解答:解:途径Ⅰ.N2、H2的起始物质的量分别为1mol和3mol;途径Ⅱ.NH3的起始物质的量为4mol,按化学计量数转化到左边,可得2molN2、6molH2,氮气与氢气的物质的量之比为1:3,与途径Ⅰ相同,恒温恒压下,途径Ⅱ与途径Ⅰ为等效平衡,同种物质的浓度相同、百分含量相同,相同反应物的转化率相同,但相同物质的物质的量途径Ⅱ是途径Ⅰ的2倍,温度相同,平衡常数相同,
A、途径Ⅱ与途径Ⅰ为等效平衡,同种物质的百分含量相同,即所得混合气体的百分组成相同,故A正确;
B、途径Ⅱ与途径Ⅰ为等效平衡,同种物质的浓度相同,故途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度相等,故B错误;
C、平衡常数只受温度影响,温度相同,平衡常数相同,故C正确;
D、途径Ⅱ与途径Ⅰ为等效平衡,平衡时,同种物质的浓度相同,同种物质表示的速率相等,速率之比等于化学计量数之比,故途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1:2,故D正确;
故选B.
点评:考查化学平衡的建立、等效平衡等,难度中等,理解等效平衡规律是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.
解答:解:途径Ⅰ.N2、H2的起始物质的量分别为1mol和3mol;途径Ⅱ.NH3的起始物质的量为4mol,按化学计量数转化到左边,可得2molN2、6molH2,氮气与氢气的物质的量之比为1:3,与途径Ⅰ相同,恒温恒压下,途径Ⅱ与途径Ⅰ为等效平衡,同种物质的浓度相同、百分含量相同,相同反应物的转化率相同,但相同物质的物质的量途径Ⅱ是途径Ⅰ的2倍,温度相同,平衡常数相同,
A、途径Ⅱ与途径Ⅰ为等效平衡,同种物质的百分含量相同,即所得混合气体的百分组成相同,故A正确;
B、途径Ⅱ与途径Ⅰ为等效平衡,同种物质的浓度相同,故途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度相等,故B错误;
C、平衡常数只受温度影响,温度相同,平衡常数相同,故C正确;
D、途径Ⅱ与途径Ⅰ为等效平衡,平衡时,同种物质的浓度相同,同种物质表示的速率相等,速率之比等于化学计量数之比,故途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1:2,故D正确;
故选B.
点评:考查化学平衡的建立、等效平衡等,难度中等,理解等效平衡规律是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.

练习册系列答案
相关题目
(6分)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填”增大”“减小”或”不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |
(1)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ;加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(2)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)
cZ(g)
右图是不同温度下反应达到平衡时,反应混合物中Z的体积分数 和压强关系示意图。
① 写出该反应的化学平衡常数表达式:K= 。随着温 度的升高,K值 (填“增大”、“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (字母填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |

 (2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5, HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。 cZ(g)
cZ(g)