题目内容
 (2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因
CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
. HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-加入石膏(CaSO4?2H2O)可以使土壤碱性降低,有关反应的化学方程式为
CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
.(2)在一定条件下进行如下反应:aX(g)+bY(g)?cZ(g)
图1是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图.
①写出该反应的化学平衡常数表达式:K=
| cc(Z) |
| ca(X)?cb(Y) |
| cc(Z) |
| ca(X)?cb(Y) |
减小
减小
(填“增大”、“减小”或“不变”).当反应物起始浓度相同时,平衡常数K值越大,表明
AB
AB
(填序号)A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
②如图2所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲乙两容器的初始体积均为1L:
甲、乙容器达到平衡所用时间:甲
>
>
乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲<
<
乙.分析:(1)Na2CO3为强碱弱酸盐,CO32-结合水电离的氢离子,生成HCO3-、H2CO3,破坏水的电离平衡;
反应生成CaCO3,CO32-浓度降低,CO32-水解平衡向左移动,OH- 浓度降低.
(2)①化学平衡常数为达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
由图1可知,温度越高,Z的含量越低,所以平衡向逆反应方向移动,据此判断;
平衡常数K值越大,反应进行的程度越大,即反应物的转化率越高.
②由图1可知,压强越高,Z的含量越高,所以平衡向正反应方向移动,即a+b>c,甲为减压,乙中压强不变,速率乙中快;
乙等效为甲加压,压强增大,平衡向体积减小的方向移动,即向正反应移动,转化率增大.
反应生成CaCO3,CO32-浓度降低,CO32-水解平衡向左移动,OH- 浓度降低.
(2)①化学平衡常数为达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
由图1可知,温度越高,Z的含量越低,所以平衡向逆反应方向移动,据此判断;
平衡常数K值越大,反应进行的程度越大,即反应物的转化率越高.
②由图1可知,压强越高,Z的含量越高,所以平衡向正反应方向移动,即a+b>c,甲为减压,乙中压强不变,速率乙中快;
乙等效为甲加压,压强增大,平衡向体积减小的方向移动,即向正反应移动,转化率增大.
解答:解:(1)Na2CO3为强碱弱酸盐,CO32-结合水电离的氢离子,生成HCO3-、H2CO3,破坏水的电离平衡,使土壤呈碱性,离子方程式CO32-+H2O HCO3-+OH- HCO3-+H2O
HCO3-+OH- HCO3-+H2O H2CO3+OH-
H2CO3+OH-
加入石膏(CaSO4?2H2O)后,与Na2CO3反应生成CaCO3,CO32-浓度降低,CO32-水解平衡向左移动,OH- 浓度降低.反应方程式为CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
故答案为:CO32-+H2O HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-;CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O;
H2CO3+OH-;CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O;
(2)①该反应的化学平衡常数表达式K=
;
由图1可知,温度越高,Z的含量越低,所以平衡向逆反应方向移动,K值减小;
平衡常数K值越大,反应进行的程度越大,即反应物的转化率越高,故选AB.
故答案为:
;减小;AB;
②由图1可知,压强越高,Z的含量越高,所以平衡向正反应方向移动,即a+b>c,甲为减压,乙中压强不变,速率乙中快,到达平衡所时间甲>乙;
乙等效为甲加压,压强增大,平衡向体积减小的方向移动,即向正反应移动,转化率增大,所以甲<乙.
故答案为:>;<.
 HCO3-+OH- HCO3-+H2O
HCO3-+OH- HCO3-+H2O H2CO3+OH-
H2CO3+OH-加入石膏(CaSO4?2H2O)后,与Na2CO3反应生成CaCO3,CO32-浓度降低,CO32-水解平衡向左移动,OH- 浓度降低.反应方程式为CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O
故答案为:CO32-+H2O
 HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-;CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O;
H2CO3+OH-;CaSO4?2H2O+Na2CO3=CaCO3↓+Na2SO4+2H2O; (2)①该反应的化学平衡常数表达式K=
| cc(Z) |
| ca(X)?cb(Y) |
由图1可知,温度越高,Z的含量越低,所以平衡向逆反应方向移动,K值减小;
平衡常数K值越大,反应进行的程度越大,即反应物的转化率越高,故选AB.
故答案为:
| cc(Z) |
| ca(X)?cb(Y) |
②由图1可知,压强越高,Z的含量越高,所以平衡向正反应方向移动,即a+b>c,甲为减压,乙中压强不变,速率乙中快,到达平衡所时间甲>乙;
乙等效为甲加压,压强增大,平衡向体积减小的方向移动,即向正反应移动,转化率增大,所以甲<乙.
故答案为:>;<.
点评:考查盐类水解、平衡常数、平衡移动等,综合性较大,难度中等,(2)中注意等效平衡思想的建立.

练习册系列答案
相关题目
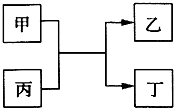 (2008?南京二模)甲、乙为单质,丙、丁为化合物,它们之间存在如图所示的转化关系.
(2008?南京二模)甲、乙为单质,丙、丁为化合物,它们之间存在如图所示的转化关系.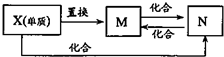 (2008?南京二模)右图中,M、N为含X元素的常见化合物.则X元素为( )
(2008?南京二模)右图中,M、N为含X元素的常见化合物.则X元素为( )