��Ŀ����
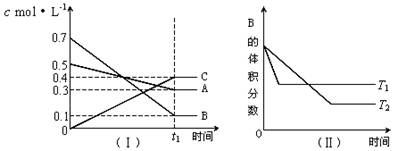
���и�ʾ��ͼ���Ӧ�ı�����ȷ����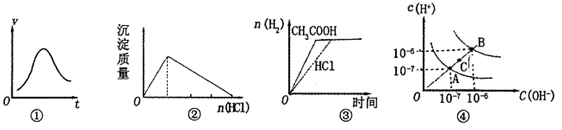
| A��ͼ�ٱ�ʾһ��������ij��ѧ��Ӧ��������ʱ��仯������ͼ���÷�Ӧһ��Ϊ���ȷ�Ӧ |
| B��ͼ�ڱ�ʾ�����ǻ�����������Һ�м������ᣬ���������������仯 |
| C��ͼ�۱�ʾ������������ʵ���Ũ�ȵ�����ʹ�����Һ���ֱ��������þ�ۣ�����H2�����ʵ����ı仯 |
| D��ͼ��Ϊˮ�ĵ���ƽ������ͼ������A�㵽C�㣬�ɲ�����ˮ�м�������NaOH����ķ��� |
B
�������������A����ͼ�ٿ�֪��һ��������ij��ѧ��Ӧ��������ʱ��仯��������С�������Ƿ��������¶�������ɵģ�Ҳ���������������и÷�Ӧ�Ĵ��������� B�������ǻ�����������Һ�м������ᣬ�����ķ�Ӧ����Ϊ[Al(OH)4]- + H+ ====Al(OH)3�� + H2O��Al(OH)3 + 3H+====Al3+ + 3H2O�����������������仯��ͼ����ʾ����ȷ��C��������������ʵ���Ũ�ȵ�����ʹ�����Һ������þ�۷�Ӧ������H2�����ʵ�����ͬ��������Ϊ������ʣ����ֵ��룬������Һ��������Ũ�Ƚ�������������Ũ��С����Ӧ����������ͼ��������D��ͼ��Ϊˮ�ĵ���ƽ������ͼ������A�㵽C�㣬ˮ�����ӻ��������ԣ�Ӧ���ü��ȵķ���������
���㣺���黯ѧͼ��ķ������漰�뻯ѧ��Ӧ���ʡ���ѧ��Ӧ��������ʵĵ�����ص�ͼ��

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д����³�ѹ�½����������������һ�𣬼�ʹ���ϼ��꣬����Ҳ���ᷢ�����Ϸ�Ӧ����ˮ��Ȼ��ֻҪ��һ�����������Ѹ����������Ӧ����ˮ����Ӧ�����е������仯����ͼA��ʾ���Ա���ͼB�е��龰�������е���ʯͷ�ġ��������൱��ͼA�е�( )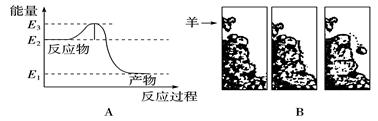
| A��E2 | B��E2-E1 | C��E3-E2 | D��E3 |
һ���¶���,���ڷ�ӦN2+O2 2NO���ܱ������н���,���д�ʩ������Ӧ���ʵ��� ( )��
2NO���ܱ������н���,���д�ʩ������Ӧ���ʵ��� ( )��
| A�������¶� | B�����ݳ��뵪�� | C����ѹ���뺤�� | D�����ݳ��뺤�� |
���й��ڻ�ѧ��Ӧ���Է�����������ȷ���� ( )
| A���ʱ�С��0���ر����0�ķ�Ӧ�϶����Է��� |
| B���ʱ���ر䶼С��0�ķ�Ӧ�϶����Է��� |
| C���ʱ���ر䶼����0�ķ�Ӧ�϶����Է��� |
| D���ر�С��0���ʱ����0�ķ�Ӧ�϶����Է��� |
��9�֣���2 L�ܱ������ڣ�800��ʱ��Ӧ2SO2(g)��O2(g) 2SO3(g)��ϵ�У�n(SO2)��ʱ��ı仯���±���
2SO3(g)��ϵ�У�n(SO2)��ʱ��ı仯���±���
| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)��ͼ��ʾ����ʾSO3�仯���ߵ���_____����O2��ʾ��0 s��2 s�ڸ÷�Ӧ��ƽ�����ʣ�v��__��
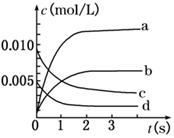
(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(SO3)��2v(O2)���� b�����������SO2������������ֲ���
c��v��(SO2)��2v��(O2) d���������ܶȱ��ֲ���
Ϊ��˵��Ӱ�컯ѧ��Ӧ���������أ��ס��ҡ���������λѧ���ֱ����������A��D�ĸ�ʵ�飬����Ϊ�ó��Ľ��۲���ȷ���� ��������
| A������ͬ�����£��������Ĵ���ʯ��ʹ���ʯ������ͬ�����ᷴӦ������ʯ�۷�Ӧ�� |
| B������ͬ��С����״��þ���������ֱ�����ͬŨ�ȵ����ᷴӦʱ����������һ���� |
| C����Ũ����ֱ�����䰵����ǿ�������£��ᷢ�ֹ��տ��Լӿ�Ũ����ķֽ� |
| D����֧�Թ��зֱ������ͬŨ����ͬ�����˫��ˮ������һ֧�Թ����ټ��뼸���Ȼ�����Һ�����������Ŀ�����ͬ |
100mL 6mol/L H2SO4������п�۷�Ӧ����һ���¶ȣ�Ϊ�ˡ�������Ӧ���е����ʣ����ֲ�Ӱ������H2��������������Ӧ���м��������� �� ��
| A��Na2CO3��Һ | B��Na2CO3���� | C��ˮ | D��NaNO3���� |
�¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g)=PCl3(g)+Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. ��Ӧ��ǰ50 s ��ƽ������v(PCl3)=" 0." 0032 mol��L-1��s-1
B. ���������������䣬�����¶ȣ�ƽ��ʱc(PCl3)=" 0." 11 mol��L-1����Ӧ��פH<0
C. ��ͬ�¶��£���ʼʱ�������г���1. 0 mol PCl5��0. 20 mol PCl3��0. 20 mol Cl2����Ӧ�ﵽƽ��ǰv(��)>v(��)
D. ��ͬ�¶��£���ʼʱ�������г���2. 0 mol PCl3��2. 0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80%